서 론
서구화된 식습관의 확산으로 비만, 당뇨, 고혈압, 아토피 등 만성 질환의 발생이 증가하고 있다. 동시에 인구 고령화와 사회 환경의 변화로 건강에 대한 관심이 높아지면서 건강기능성식품의 중요성이 부각되고 있다(Ryu et al., 2017). 특히, 장 건강과 밀접하게 연관된 프로바이오틱스(probiotics) 시장이 전 세계적으로 급성장하고 있으며, 건강 증진과 질병 예방을 위한 핵심적인 분야로 주목받고 있다.
프로바이오틱스는 인간 또는 동물 숙주의 건강에 이로운 역할을 하는 살아있는 미생물로, 기본적으로 유익균 증식, 유해균 억제, 배변 활동 원활 등 장 건강에 도움을 주며, 균주의 특성에 따라 괴사성 장염, 위장 감염, 과민성 대장증후군의 예방과 치료에 효과가 있다고 알려졌다(Bang et al., 2012; Kang et al., 2019). 최근 연구에서는 프로바이오틱스가 장 건강 개선뿐만 아니라 면역 조절, 체지방 감소, 항고혈압, 항암, 항산화, 아토피 개선, 콜레스테롤 저하 등 다양한 기능성 효과를 발휘하는 것으로 보고되고 있다(Ghoneim and Moselhy, 2016). 프로바이오틱스 균주로는 Lactobacillus, Lacticaseibacillus, Limosilactobacillus, Lactiplantibacillus, Streptococcus, Enterococcus, Bifidobacterium 속 등의 미생물이 주로 이용된다. 이들 미생물은 비병원성, 비용혈성, 무독성 등의 안전성이 필수적으로 보장되어야 하며, 산성과 담즙에 대한 내성을 갖추어 위장관 환경에서 생존할 수 있어야 하고, 장세포에 잘 정착하여 기능성을 발휘해야 한다(Shin et al., 2021). 그러나 프로바이오틱스로 이용되는 생균은 열과 산에 취약하며, 산업화를 위한 제품 제조 공정과 유통 과정에서 안정성을 확보하기 위해 충분한 양을 투여해야 하는 문제점이 있다(Ardestani et al., 2019). 최근 프로바이오틱스의 오남용 및 과잉 섭취로 인한 설사, 복통, 두통, 변비, 알레르기 등의 부작용 사례가 증가하고 있으며, 신생아와 면역이 저하된 환자에게 투여할 경우 국소 조직과 혈액으로 침투하여 균혈증과 패혈증을 일으킬 수 있다는 우려가 보고된 바 있다(Pique et al., 2019). 따라서 생균보다 안전하며 유사한 생리활성을 나타내는 사균체가 기능성식품 소재로 큰 관심을 받고 있다.
파라프로바이오틱스(paraprobiotics)는 사멸 처리를 통해 비활성화된 프로바이오틱스의 사균체로, 최근 여러 연구를 통해 생균과 유사한 건강상의 이점을 제공한다는 것이 밝혀지면서 차세대 기능성 소재로 많은 주목을 받고 있다. 특히, 사균체는 생균보다 안전하여 생균 처방이 어려운 고위험군도 섭취가 가능하며, 안정성과 운반의 편리성을 갖춘 천연 첨가물로써 건강기능식품, 일반식품, 제약, 화장품 등 광범위한 분야에 적용할 수 있는 장점이 있다. 파라프로바이오틱스의 제조 방법으로는 열처리, 초음파, 자외선, 감마선, 화학물질 등 다양한 방법이 있으나, 일반적으로 열처리 방법이 가장 널리 이용되고 있다. 열처리 방법은 공정이 단순하고, 미생물의 균일한 멸균이 가능하며, 온도 조건에 따라 세포벽의 파괴 정도를 조절할 수 있는 장점이 있다(Almada et al., 2016). 파라프로바이오틱스의 생리활성 성분으로는 열처리 과정에서 용출된 exopolysaccharide, teichoic acid, peptidoglycan, cell surface protein 등이 알려지고 있다(Lee et al., 2023). 현재까지 Lactobacillus와 Bifidobacterium 속 프로바이오틱스의 사균체를 이용한 연구를 통해 항산화, 항염, 항암, 면역 조절, 인지능력 향상 등의 건강 기능성이 보고되고 있으나(Averina et al., 2021; Ma et al., 2021), 다양한 프로바이오틱 유산균주를 이용한 생리활성 연구는 부족한 실정이다.
활성산소종(reactive oxygen species, ROS)은 정상적인 생체 대사 과정에서 미토콘드리아, 소포체 및 퍼옥시좀에서 생성되며, 적정한 수준의 농도에서는 세포신호 전달에 작용하여 세포 증식, 세포 분화, 세포의 생존 등 항상성을 유지하는데 관여한다. 그러나 지속적으로 과도한 산화적 스트레스에 노출되면 과잉의 ROS 생성으로 불포화지방산, 단백질, DNA 등과 같은 생체분자에 산화적 손상을 일으켜 세포 사멸과 괴사를 일으킨다(Yeon et al., 2013). 이러한 산화적 손상은 염증 반응을 초래하고, 염증 반응이 지속되면 만성염증으로 발전하여 각종 질환의 발병 요인으로 작용한다(Wang et al., 2017). 염증(inflammation)은 외부의 감염이나 조직의 손상으로부터 생체를 보호하고 회복하기 위한 반응으로 세포의 손상 억제, 괴사된 세포 제거, 파괴된 조직 재생 등 신체를 방어하기 위한 작용이다. 대식세포(macrophage)는 염증 반응에 중요한 역할을 하는 세포로 외부자극에 반응하여 tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), interleukin-1β(IL-1β) 등의 전염증성 사이토카인(pro-inflammatory cytokine)을 분비하고, nitric oxide(NO)와 prostaglandin E2(PGE2) 등의 염증 매개 물질을 생성한다. 이를 통해 다른 면역세포들을 활성화하고, 염증 원인을 제거하며, 손상된 부위를 정상적으로 복구하는 조절자 역할을 수행한다. 하지만 산화적 스트레스 또는 lipopolysaccharide(LPS) 등에 의해 과도하게 활성화된 대식세포는 전염증성 사이토카인과 염증매개 물질의 분비를 촉진하여 염증 반응을 지속시키고 만성염증으로 발전시켜 암, 대사증후군, 심혈관계질환, 관절염, 퇴행성 뇌질환 등 각종 질환을 유발할 수 있다(Zong et al., 2012). 현재까지 프로바이오틱스로 활용되고 있는 Lactobacillus와 Bifidobacterium 속의 생균이 항산화 및 항염 활성을 나타낸다는 많은 연구 결과들이 보고되었다(Plaza-Diaz et al., 2017; Wang et al., 2017). 하지만, 프로바이오틱스의 사균체를 활용한 항산화 및 항염 연구는 매우 부족한 편이며, 김치 등 전통 발효식품에서 분리되고 있는 Limosilactobacillus fermentum 균주의 생균과 열처리 사균체를 활용한 연구는 미흡하여 이에 대한 연구가 필요하다.
본 연구에서는 백김치에서 분리된 유산균 중 내산성, 내담즙성, 장부착능이 우수한 2종의 L. fermentum 균주를 선별하고, 이들의 프로바이오틱스 활성을 평가하였다. 또한, 선별된 유산균을 열처리하여 사균체를 제조하고, 생균과 비교하여 항산화와 항염 활성을 측정함으로써 항산화 및 항염 활성을 지닌 기능성 소재로서의 가능성을 평가하고자 하였다.
재료 및 방법
충남 천안과 아산 지역의 전통시장에서 수집한 백김치에서 유산균을 분리하여 사용하였다. 백김치 시료를 멸균된 0.85% saline에 1:9(w/v) 비율로 첨가한 후, stomacher(BagMixer 400W, Interscience, Saint Nom, France)를 이용하여 마쇄하였다. 마쇄한 용액을 10배수로 희석하여 De Man-Rogosa-Sharpe agar(MRS, DifcoTM, MD, USA) 고체배지에 도말하고 37℃에서 overnight 배양하여 단일 콜로니를 분리하였다. 분리된 단일 콜로니를 Bromocresol Purple(BCP, Eilken chemical Co., Ltd., Tokyo, Japan) 고체배지에 도말하여 배양한 후 노란색 환이 생성된 콜로니를 유산균으로 판단하고 선별하였다. 선별한 균주의 16S rRNA 유전자 염기서열은 universal rRNA gene primer(27F와 1492R)를 이용하여 증폭하였고, BIOFACT사(Daejeon, Korea)에서 염기서열 분석을 의뢰하여 수행되었다. 분석된 16S rRNA 염기서열 데이터는 National Center for Biotechnology Institute(NCBI)의 BLAST 프로그램을 이용하여 GenBank 데이터베이스와 비교하였다. 대조군으로 사용된 상업용 프로바이오틱스 유산균주인 Lactobacillus rhamnosus GG(KCTC 5033)는 생물자원센터(Daejeon, Korea)에서 분양받았다.
선별한 유산균주를 MRS 액체배지(Difco, BD Biosciences, USA)에 접종하고 37℃에서 18시간 배양하였다. 배양액을 원심분리(12,000×g, 4℃, 10 min)한 후 phosphate buffered saline (PBS, Welgene, Korea) 용액(pH 7.4)으로 세척하고 동결건조(FDU-12000, EYELA, Korea)하였다. 동결건조된 생균을 PBS 용액(pH 7.4)을 사용하여 약 1×109 CFU/mL의 농도인 1 mg/mL로 조정하여 실험에 사용하였다. 사균체 시료는 위와 동일한 방법으로 1 mg/mL 농도의 동결건조된 생균을 121℃에서 15분간 고압멸균(AC-12, JEIO TECH, Korea)하여 제조한 후 사용하였다.
본 연구에 사용된 세포주인 HT-29 세포(KCLB30038)와 RAW 264.7 세포(KCLB40071)는 한국세포주은행에서 구입하였다. 인간 결장 유래 HT-29 세포는 1% penicillin-streptomycin 용액(Cytiva, Marlborough, USA)이 함유된 RPMI(Roswell Park Memorial Institue 1640, Welgene, Korea) 배지에 10% fetal bovine serum(FBS)을 첨가하여 배양하였으며, dish에 세포가 90% 이상 자랐을 경우 새로운 dish에 계대배양하였다. 마우스 유래 대식세포인 RAW 264.7 세포는 1% penicillin-streptomycin solution(Cytiva, Marlborough, USA)이 함유된 DMEM(Dulbecco’s modified Eagle’s medium, Welgene, Gyeongsan, Korea) 배지에 10% FBS를 첨가하여 배양하였으며, 2일 주기로 새로운 dish에 계대배양하였다. 세포 배양은 37℃, 5% CO2 조건을 유지하는 incubator(Thermo Fisher, Massachusetts, USA)에서 수행되었다.
유산균의 내산성과 내담즙성 측정은 Bae 등(2023)의 방법을 일부 수정하여 측정하였다. 선별한 유산균을 MRS 액체배지에서 배양(37℃, overnight)한 후 1×109 CFU/mL 수준의 농도로 조정하였다. 내산성 평가를 위하여 pH 2.5로 조정한 MRS 액체배지에 0.3% pepsin(Sigma-Aldrich, MO, Wyoming, USA)을 첨가한 후 유산균 농도가 약 1×107CFU/mL 수준이 되도록 배양액(1×109 CFU/mL)을 1%(v/v) 접종하고 37℃에서 3시간 반응하였다. 반응액을 MRS 고체배지에 도말하고 37℃에서 배양한 후 생존율을 확인하였다. 내담즙성 평가의 경우, 0.3% oxgall(DifcoTM, MD, USA)이 첨가된 MRS 액체배지에 배양액을 1%(v/v) 접종하여 37℃에서 24시간 반응시킨 후 MRS 고체배지에 도말하고 37℃에서 배양한 다음 생균수를 측정하였다. 생존율은 다음의 계산식을 사용하여 계산하였다.
유산균의 용혈성은 Kim 등(2019)의 방법을 일부 수정하여 측정하였다. 5% defibrinated sheep blood가 첨가된 sheep blood agar(Kisan Bio co., Seoul, Korea)를 제조한 후 실험에 사용하였다. 선별된 유산균을 MRS 액체배지에 1%(v/v) 접종하여 배양한 후 Sheep blood agar에 획선 도말하여 37℃에서 48시간 배양하였다. 배양 후 콜로니 주변에 생긴 색상의 변화를 비교하여 용혈 활성 유무를 확인하였다. β-용혈능에 대한 양성 대조군으로 Staphylococcus aureus를 사용하였다.
인간 결장 유래 장세포(HT-29)와 마우스 유래 대식세포(RAW 264.7)에 대한 유산균 시료의 독성 평가는 MTT (methylthizol- 2-yl-2,5-diphenyl tetrazolium bromide) 방법을 이용하였다(Park and Lee, 2022). 장세포는 RPMI 배지를 사용하였으며, 대식세포는 DMEM 배지를 사용하였다. 세포를 96 well plate에 1×105 cell/well의 농도로 접종한 후 5% CO2 농도의 배양기에서 37℃, 24시간 배양하였다. 배양액으로부터 상등액을 제거한 후 배지 180 μL와 유산균 시료 20 μL를 분주하여 24시간 배양하였다. 배양액을 PBS 용액으로 3번 세척한 후 배지 180 μL와 MTT(5 mg/mL) 20 μL를 첨가하고 4시간 동안 반응시킨 후 상등액을 제거하였다. 반응에 의해 생성된 MTT-formazan 생성물을 Dimethyl sulfoxide(DMSO, Daejung, Siheung, Korea)를 첨가하여 용해시킨 후 Microplate reader(SPECTRO star Nano, BMG LABTECH, Germany)를 이용하여 570 nm에서 흡광도를 측정하였다. 세포 생존율(%)은 다음 계산식을 이용하여 계산하였으며, 대조군으로 PBS 용액을 사용하였다.
장세포 부착능은 Jung과 Kim(2015)의 방법을 일부 수정하여 진행하였다. MRS 액체배지에서 배양(37℃, overnight)한 유산균을 PBS 용액으로 2회 세척한 후 1×109 CFU/mL로 농도를 조절한 현탁액을 실험에 사용하였다. 6 well plate에 10% FBS가 첨가된 RPMI 배지를 첨가하고 HT-29 세포를 1×106 cell/well의 농도로 접종한 후 5% CO2 농도의 배양기에서 37℃, 24시간 배양하였다. 배양 후 상등액을 제거하고 RPMI 배지 1 mL와 유산균 현탁액 1 mL를 첨가하여 1시간 반응하였다. PBS 용액으로 HT-29 세포를 3회 세척하여 부착되지 않은 유산균을 제거하였다. 이후 0.1% Triton X-100 용액(Samchun, Seoul, Korea) 1 mL를 첨가하여 세포에 부착된 유산균을 회수하였다. 회수한 유산균을 MRS 고체배지에 접종하고 배양하여 생균수를 측정한 후 다음의 계산식에 따라서 장부착능(%)을 계산하였다.
DPPH radical 소거능은 Kim 등(2013)의 방법을 일부 변형하여 수행하였다. 2,2-Diphenyl-1-picryhydrazyl(Sigma, Milano, Italy)과 에탄올을 혼합하여 0.4 mM DPPH 시약(OD517nm=1.2)을 제조한 후, 유산균 시료와 1:1로 혼합하여 암실에서 30분간 반응시켰다. 반응액을 원심분리(12,000 ×g, 4℃, 5 min)한 후 회수한 상등액의 흡광도를 517 nm에서 측정하고, 다음의 계산식을 통해 DPPH 라디칼 소거능(%)을 계산하였다. 대조군으로 PBS 용액을 사용하였다.
ABTS radical 소거능은 Cheon 등(2020)의 방법을 일부 변형하여 수행하였다. pH 7.4로 조정된 0.2 M sodium phosphate buffer 용액에 7 mM ABTS와 5 mM potassium persulfate 시약을 혼합하고 암실에서 16시간 반응하여 ABTS+ 라디칼을 형성시킨 후 증류수를 이용하여 734 nm에서 흡광도가 0.7이 되도록 조정하였다. ABTS 시약 1.35 mL와 유산균 시료 150 μL를 혼합하여 반응(37℃, 10 min)시킨 후 원심분리(12,000 ×g, 4℃, 5 min)하여 회수한 상등액의 흡광도를 734 nm에서 측정하였다. 다음의 계산식을 통해 ABTS 라디칼 소거능(%)을 계산하였으며, 대조군은 PBS 용액을 사용하였다.
β-Carotene bleaching 억제능 측정은 Bibi 등(2020)의 방법을 일부 수정하여 진행하였다. 감압플라스크에 linoleic acid(Sigma- Aldrich, Saint Louis, USA) 66 μL, β-carotene 3 mg, tween 80(Sigma-Aldrich) 300 μL, chloroform 10 mL를 가하여 혼합한 후 회전감압농축기(SB-1200, EYELA, Bohemia, USA)를 이용하여 40℃의 진공 상태에서 chloroform을 증발시켰다. 이후 증류수를 75 mL를 가하여 β-carotene-linoleic acid 시약을 제조하고, 시약의 농도를 OD470nm=2.0으로 조정하여 사용하였다. 유산균 시료 200 μL와 β-carotene-linoleic acid 용액 4 mL를 혼합하여 50℃의 항온수조에서 2시간 동안 반응시킨 후 470 nm에서 흡광도를 측정하였다. 다음의 계산식에 따라 β-carotene bleaching 억제능(%)을 계산하였으며, 대조군으로 PBS 용액을 사용하였다.
1) ODsample 2h : absorbance of sample for 2 h
2) ODcontrol 2h : absorbance of after control for 2 h
3) ODcontrol 0h : absorbance of control for 0 h
Quantitative real-time polymerase chain reaction (qRT-PCR)을 이용하여 TNF-α, IL-6, iNOS, COX-2의 유전자 발현을 측정하였다(Cheon et al., 2020). RAW 264.7 세포를 6 well plate에 1×106 cell/well의 농도로 접종한 후 5% CO2 농도의 배양기에서 37℃, 24시간 배양하였다. 상등액을 제거하고 각 well 당 1 μg/mL의 LPS가 첨가된 DMEM 배지와 유산균 시료(1×109CFU/mL)를 첨가하고 24시간 반응시켰다. 반응 후 PBS 용액으로 세척한 다음, 세포를 Trizol(Life technologies, carlsbad, california, USA)용액을 사용하여 회수하였다. RNeasy mini kit(Qiagen, Hilden, Germany)를 이용하여 세포로부터 total RNA를 추출하고 NanoDrop(biochrom, Cambridge, USA)을 사용하여 농도를 정량하였다. cDNA는 cDNA synthesis kit(TAKARA, Shigaken, Japan)를 이용하여 합성하였으며, primer는 코스모진텍(Seoul, Korea)에서 합성하여 사용하였다(Table 1). StepOnePlusTM Real-time PCR System(Thermo Fisher, Massachusetts, USA)을 이용하여 PCR을 진행하였다. PCR 반응액은 primer 2 μL, cDNA 2 μL, SYBR green(Cosmogenetech, Seoul, Korea) 10 μL, 증류수 6 μL를 혼합하여 총량이 20 μL가 되도록 하였다. PCR은 95℃에서 15초(denaturation), 60℃에서 60초(annealing/extension) 반응으로 40회 반복하여 진행하였다. Reference gene으로 GAPDH를 사용하였으며, 각 유전자의 threshold cycle(Ct) 값을 비교하여 delta-delta Ct(ΔΔCt)법으로 계산하고 결과를 분석하였다.
| Gene1) | Sequences | References |
|---|---|---|
| TNF-α | F : 5'-CGTCAGCCGATTTGCTATCT-3' | You et al., 2022 |
| R : 5'-CGGACTCCGCAAAGTCTAAG-3' | ||
| IL-6 | F : 5'-GTACTCCAGAAGACCAGAGG-3' | |
| R : 5'-TGCTGGTGACAACCACGGCC-3' | ||
| iNOS | F : 5'-CTGCAGCACTTGGATCAGGAACCTG-3' | |
| R : 5'-GGGAGTAGCCTGTGTGCACCTGGAA-3' | ||
| COX-2 | F : 5'-CCGTGGTGAATGTATGAGCA-3' | |
| R : 5'-CCTCGCTTCTGATCTGTCTT-3' | ||
| GAPDH | F : 5'-TGCACCACCAACTGCTTA-3' | |
| R : 5'-GGATGCAGGGATGATGTT-3' |
결과 및 고찰
백김치 시료를 BCP 고체배지에 접종하여 배양한 후, 산 생성에 의해 노란색의 환을 형성한 콜로니를 유산균으로 간주하였다. 이 중 크기가 큰 70개의 콜로니를 선별하여 내산성, 내담즙성, 장부착능, 항산화 활성(DPPH, ABTS radical scavenging activity)을 측정하였고, 프로바이오틱스 특성이 가장 우수한 2종을 균주(SMF680, SMF709)를 최종 선별하였다. 최종 선별된 2종의 균주는 간균 형태의 Gram 양성균으로 catalase 음성을 나타내는 것이 확인되었다. 16S rRNA sequencing 분석을 바탕으로 NCBI database를 통해 염기서열의 상동성을 분석한 결과, 2종의 균주는 Limosilactobacillus fermentum과 각각 98.94%, 96.42%의 높은 상동성을 나타내어 Limosilactobacillus fermentum SMF680과 Limosilactobacillus fermentum SMF709로 명명하였다.
유산균이 프로바이오틱스로서 효능을 발휘하기 위해서는 소화관에서 생존하여 장까지 도달해야 하므로, 위액과 담즙염에 대한 저항성을 갖추어야 한다(Park et al., 2013). 선별된 유산균의 내산성 및 내담즙성을 측정한 결과는 Table 2와 같다. Pepsin이 첨가된 pH 2.5의 인공 위액 조건에서 L. fermentum SMF680과 L. fermentum SMF709는 각각 102.14%와 103.46%의 생존율을 나타내어, 상업용 프로바이오틱스 균주인 Lacticaseibacillus rhamnosus GG(LGG, 102.44%)와 유사한 결과를 보였다. 3종의 유산균 모두 100% 이상의 생존율을 나타내어, 위산에 대한 저항성을 갖고 있는 것으로 확인되었다. Oxgall이 0.3% 첨가된 배지에서 LGG, SMF680, SMF709 균주의 생존율을 측정한 결과, 각각 103.15%, 100.82%, 100.74%의 생존율을 보여 3종의 균주 모두 담즙염에 대한 저항성이 높은 것으로 나타났다. Seo와 Lee(2007)는 Lactobacillus acidophilus DDS-1과 Lactobacillus acidophilus B-3208 균주가 pH 2.5의 산성에서 50% 이상의 생존율을 나타내었다고 보고하였다. Bae 등(2023)은 발효식품에서 분리된 유산균이 108~109 log CFU/mL의 농도에서 담즙염에 대하여 100.99%-104.03%의 생존율을 보였으나, 104log CFU/mL 이하의 농도에서는 민감성을 나타내었다고 보고하였다. 본 연구결과, 선별된 SMF680과 SMF709 균주는 위산과 담즙염에 대한 높은 저항성을 나타내어 프로바이오틱스의 선별 조건에 부합한다고 판단된다.
선별된 유산균주가 적혈구를 분해하거나 파괴하는 용혈성을 보유하고 있는지를 확인하기 위한 검사를 진행하였다(Table 3). Sheep blood 배지의 성분인 hemoglobin이 미생물의 용혈 활성으로 인해 분해될 경우 주변 환의 형성 유무 및 색상에 의해 α형, ß형, γ형으로 구분된다. 적혈구를 불완전 용해하는 경우 녹색 환을 생성하는 α형, 적혈구를 완전 용해하여 투명 또는 노란색 환을 생성하는 ß형, 용혈 활성이 없어 환을 생성하지 않는 γ형으로 판단하였다(Woo et al., 2022). 대조군으로 사용된 S. aureus 균주는 녹색 환을 생성하여 α형을 나타낸 반면, LGG, SMF680, SMF709 균주는 색상 변화가 관찰되지 않아 용혈 현상이 없는 γ형의 안전한 균주임을 확인하였다.
| Contents | Strains | |||
|---|---|---|---|---|
| L. rhamnosus GG | L. fermentum SMF680 | L. fermentum SMF709 | ||
| Hemolysis | α | -1) | - | - |
| ß | - | - | - | |
| γ | + | + | + | |
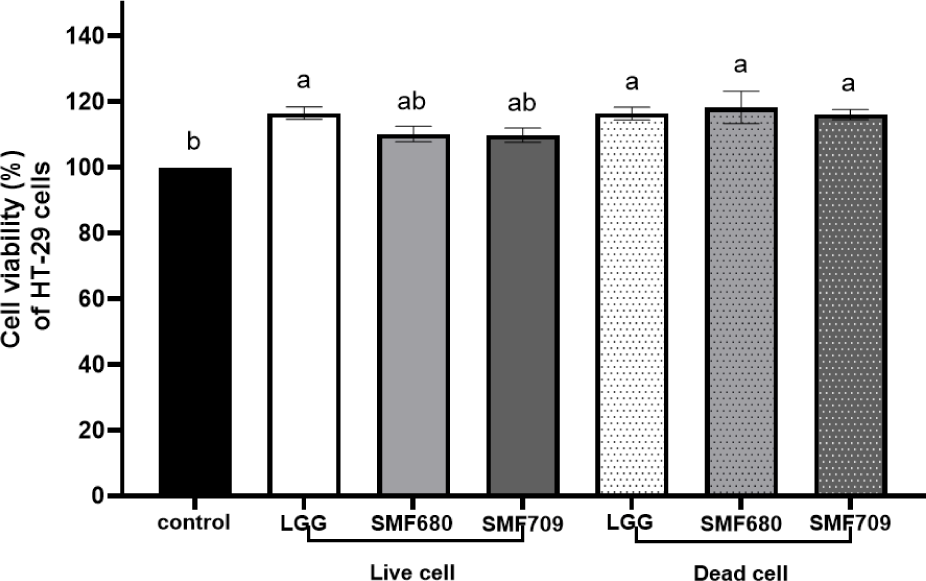
MTT assay를 이용하여 선별된 유산균주에 따른 HT-29 세포의 생존율을 분석하였다(Fig. 1). HT-29 세포에 각 유산균의 생균과 사균체를 1 mg/mL(약 1×109 CFU/mL)의 농도로 처리한 후 HT-29 세포의 생존율을 분석한 결과, 모든 생균 및 사균체 시료에 대하여 100% 이상의 생존율을 나타내었다. 따라서 본 연구에서 사용한 유산균 시료는 장세포에 대해 세포 독성을 나타내지 않는 안전한 균으로 판단된다.
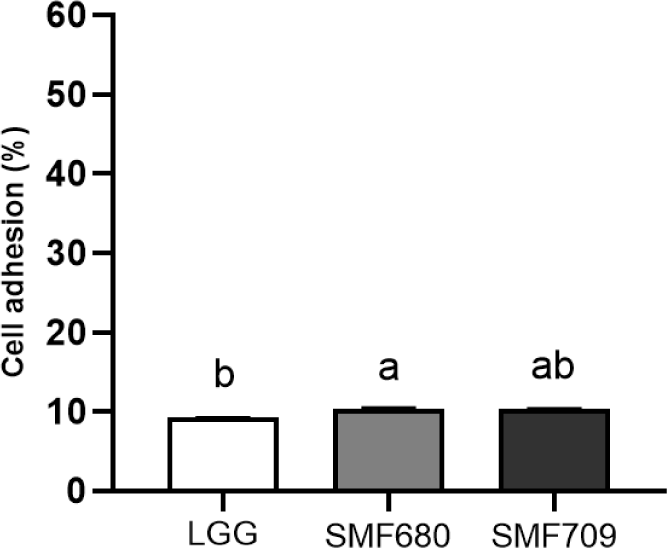
유산균이 위와 십이지장을 통과한 후 장에 정착하여 유용한 효과를 발휘하기 위해서는 장 상피세포에 부착할 수 있는 능력이 요구된다(Lee et al., 2016). 인간 결장 유래 HT-29 세포를 이용하여 유산균의 장부착능을 측정한 결과는 Fig. 2와 같다. SMF680과 SMF709의 장세포 부착능은 각각 10.59%, 10.12%로 상업균주인 LGG(9.36%)와 비교하여 우수한 장부착능을 나타내었다. Lee 등(2014)은 김치에서 분리된 L. plantarum SY11 균주와 L. plantarum SY12 균주가 각각 7.2%와 5.3%의 장부착능을 나타내었다고 보고한 바 있다. 프로바이오틱스는 장 점막세포에 부착하고 군락을 형성하여 mucin 생성 촉진, 면역 조절, 병원균 억제, 장 투과성 감소 등 유용한 작용을 한다고 알려졌다(Liu et al., 2010; Monteagudo-Mera et al., 2019). 본 연구결과, 선별된 SMF680과 SMF709는 내산성, 내담즙성, 장세포 부착능이 우수하여 프로바이오틱스 선별 조건에 부합된다고 사료된다.
유산균의 항산화 활성은 DPPH 라디칼 소거능, ABTS 라디칼 소거능 및 β-carotene bleaching 억제능을 측정하여 평가하였다. DPPH는 보라색의 매우 안정한 free radical로 항산화 물질에 의해 탈색되는 원리를 이용한다(Park et al., 2018). SMF680 사균체(24.93%)는 생균(30.02%)과 비교하여 유의적으로 낮은 DPPH 라디칼 소거능을 보였으나(p<0.05), SMF709 사균체(29.91%)는 생균과(31.01%) 유사한 소거능을 나타내었다(Fig. 3A). 상업 균주인 LGG와 비교하여, SMF680과 SMF709의 생균과 사균체 모두 유의적으로 높은 소거능을 보였다(p<0.05). Jang 등(2018)은 Lactiplantibacillus plantarum Ln1 생균과 Lactiplantibacillus plantarum KCTC 3108 생균이 각각 24.16%와 21.13%의 DPPH 라디칼 소거능을, Hyun 등(2024)은 Lactobacillus sakei KU15041 사균체와 Lactobacillus curvatus KU15003 사균체가 각각 15.29% 와 18.84%의 DPPH 라디칼 소거능을 나타내었다고 보고한 바 있다.
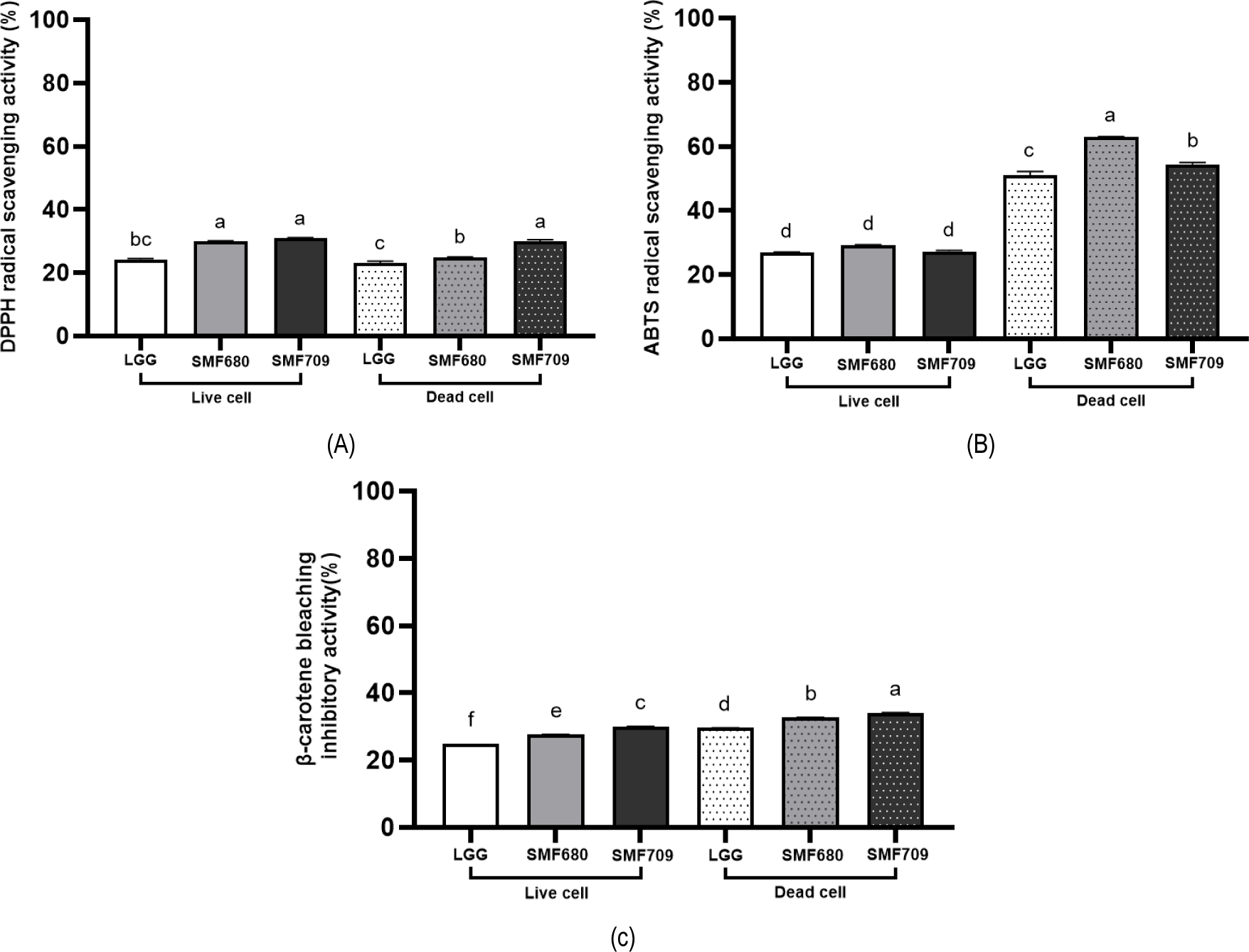
ABTS 라디칼 소거능은 potassium persulfate와 ABTS의 반응에 의해 생성된 청록색의 ABTS 라디칼이 항산화 물질에 의해 탈색되는 원리를 이용한다(Yang et al., 2014). LGG, SMF680, SMF709 사균체의 ABTS 라디칼 소거능은 각각 51.06%, 62.95%, 54.43%로 생균과 비교하여 1.9배, 2.2배, 2배 유의적으로 높은 라디칼 소거능을 나타내었으며, SMF680 사균체에서 가장 높은 소거능이 확인되었다(Fig. 3B)(p<0.05). Song 등(2019)은 ABTS 라디컬 소거능 평가에서 LGG 사균체와 Levilactobacillus brevis KCCM 12203P 사균체가 생균보다 각각 1.6배와 1.7배 높은 소거 활성을 나타내었다고 보고한 바 있다. 본 연구 결과, 생균과 사균체의 항산화 활성은 DPPH 라디칼 소거능에서 유사한 반면, ABTS 라디칼 소거능에서 뚜렷한 차이점을 나타내었다. 이와 같은 결과는 자유 라디칼인 DPPH와 양이온 라디칼인 ABTS의 구조적 차이에서 비롯된 것으로 DPPH는 비극성 물질과만 반응하는 반면, ABTS는 극성 및 비극성 물질에 모두 반응할 수 있어 이러한 차이가 라디칼 소거 활성에 영향을 미친 것으로 보인다(Kim et al., 2013). β-Carotene bleaching 억제능은 리놀레산의 산화에 의해 β-Carotene이 탈색되는 현상을 이용하는데, 항산화 물질이 탈색 현상을 억제하는 원리를 기반으로 지질과산화 억제 능력을 측정하는 방법이다(Loucif et al., 2020). LGG의 생균 및 사균체와 비교하여, SMF680과 SMF709의 생균 및 사균체는 각각 유의적으로 높은 소거능을 보였다(p<0.05). SMF680과 SMF709 사균체의 β-carotene bleaching 억제능은 각각 32.66%와 34.03%로, 생균의 27.60%와 29.98% 보다 높은 지질과산화 억제능을 나타내었다(Fig. 3C). Jang 등(2018)은 Lactiplantibacillus plantarum Ln1의 사균체(58.33%)가 생균(49.97%)보다 높은 β-carotene bleaching 억제능을 나타내었다고 보고하였다.
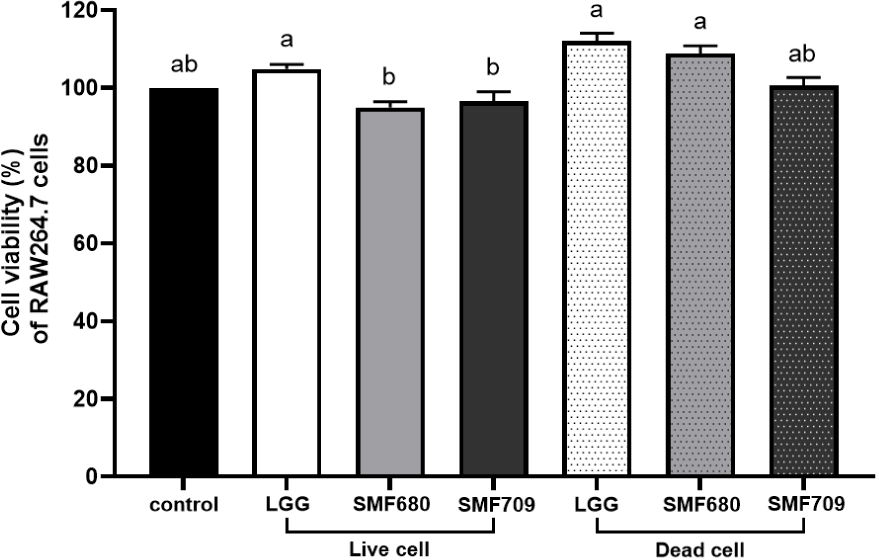
항염증 효과를 평가하기에 앞서 RAW 264.7 세포에 각 유산균의 생균과 사균체를 1 mg/mL(약 1×109 CFU/mL)의 농도로 처리한 후 RAW 264.7 세포의 생존율을 측정하였다(Fig. 4). 모든 생균과 사균체 시료에 대하여 RAW 264.7 세포는 95% 이상의 생존율을 나타내었다. 따라서 RAW 264.7 세포에 대하여 독성을 나타내지 않는 1 mg/mL 농도의 생균과 사균체를 이용하여 항염 활성을 평가하였다.
RAW 264.7과 같은 대식세포는 LPS의 자극에 의해 TNF-α, IL-6와 같은 전염증성 사이토카인과 NO, COX-2 등의 염증성 매개인자들의 생성을 촉진하여 염증을 악화시키고 암, 죽상경화증, 염증성 장질환, 신경퇴행성 질환, 류마티스 관절염 등 각종 질환의 발병 요인으로 작용한다(Monteagudo et al., 2019). TNF-α와 IL-6는 주로 활성화된 대식세포에서 분비되는 사이토카인으로 염증 자극에 반응하여 숙주의 염증 촉진 및 면역 조절에 관여한다(Umare et al., 2014). NO는 주로 iNOS의 효소작용에 의해 생성되어 혈관 확장과 면역 조절에 관여하지만, 과도한 생성은 COX-2 등 염증 매개체의 생합성을 촉진하고 염증을 심화시킨다. COX-2는 arachidonic acid로부터 통증과 발열을 일으키는 물질인 PGE2의 생성을 촉진하는 효소로 염증 반응에서 중요한 역할을 한다(Kurumbail et al., 2001). 따라서 LPS의 자극에 의해 대식세포에서 과도하게 생성되는 TNF-α, IL-6, iNOS, COX-2의 발현 억제는 염증성 질환의 예방과 치료를 위한 주요 표적으로 이용된다.
본 연구에서는, LPS에 의해 염증이 유도된 RAW 264.7 세포에 유산균 생균 또는 사균체를 첨가하고 TNF-α, IL-6, iNOS, COX-2의 발현을 평가하였다(Fig. 5). LPS 단독처리군(+)과 비교하여, LGG, SMF680, SMF709의 생균 또는 사균체 첨가군에서 TNF-α, IL-6, iNOS, COX-2의 발현이 유의적으로 억제되는 것이 확인되었다(p<0.05). LPS 단독처리군(+)과 비교하여, SMF680 생균 첨가군에서 TNF-α, IL-6, iNOS, COX-2의 발현이 각각 66.35%, 71.08%, 52.78%, 48.02% 억제되었으며, 사균체 첨가군에서는 각각 66.91%, 68.11%, 57.11%, 50.12% 억제되는 것으로 나타났다. SMF709의 경우, TNF-α, IL-6, iNOS, COX-2의 발현이 생균 첨가군에서는 각각 50.41%, 78.46%, 71.66%, 61.04%, 사균체 첨가군에서는 각각 58.27%, 73.86%, 81.93%, 65.75% 억제되었다. 반면, LGG 생균 첨가군에서 TNF-α, IL-6, iNOS, COX-2의 발현이 각각 45.52%, 62.37%, 47%, 42.44%, 사균체 첨가군에서는 각각 44.03%, 61.19%, 51.37%, 48.41% 억제되었다. 본 연구에서 선별된 유산균(SMF680, SMF709)의 생균과 사균체 모두 상업균주인 LGG보다 TNF-α, IL-6, iNOS, COX-2의 발현 억제 활성이 높았으며, 특히 SMF709 사균체는 iNOS와 COX-2의 발현 억제 활성이 가장 우수한 것으로 확인되었다. You 등(2022)은 Lactiplantibacillus plantarum KCTC3108의 열처리 사균체가 TNF-α, IL-6, iNOS, COX-2의 발현을 각각 34.86%, 51.67%, 44.36%, 28.06% 억제하였다고 보고한 바 있다. 현재까지 열처리 사균체의 항염 작용 기작이 명확히 밝혀지지 않았지만, 유산균의 세포 성분인 EPS, peptidoglycan, lipoteichoic acid 등이 면역조절에 관여한다고 알려졌다(Pique et al., 2019). Kwon 등(2020)은 Lactiplantibacillus plantarum L-14에서 분리된 EPS가 LPS 처리에 의해 활성화된 RAW 264.7 세포에서 TLR4와 MyD88의 신호전달을 억제하고 NF-κB와 MAPK 경로를 하향 조절하여 TNF-α, IL-6, iNOS, COX-2와 같은 염증성 매개체의 발현을 억제하였다고 보고하였다.
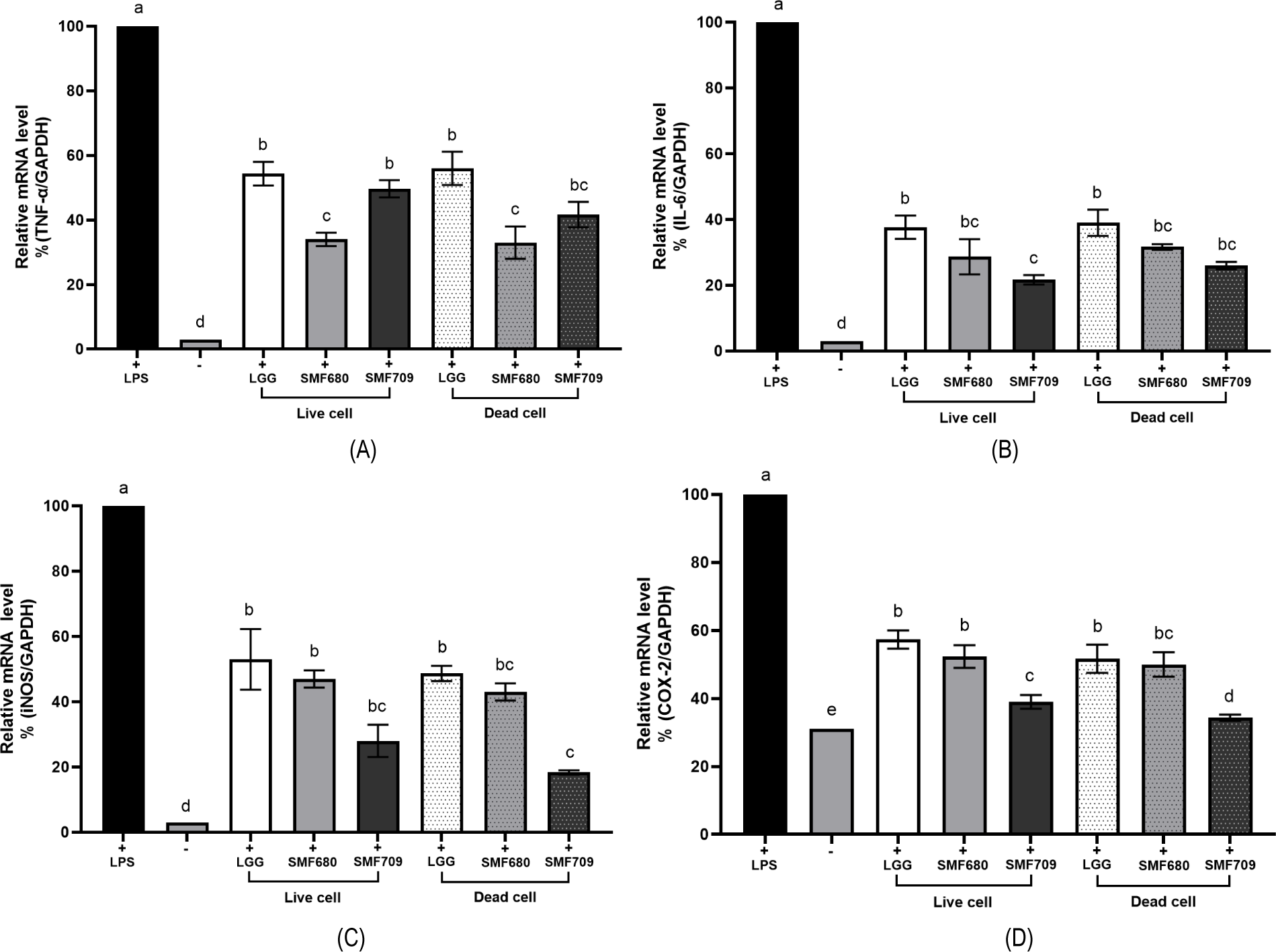
본 연구 결과, 백김치에서 분리된 L. fermentum SMF680과 L. fermentum SMF709 균주는 내산성, 내담즙성 및 장세포 부착능이 우수하여 프로바이오틱스 균주의 조건에 부합하였다. 이들의 생균과 열처리 사균체 모두 항산화 및 항염 활성이 우수하여 항산화제 및 항염제로 개발이 가능할 것으로 판단된다. 특히, 선별된 유산균의 열처리 사균체는 안전하게 섭취할 수 있는 천연 첨가물로서 식품, 제약 및 화장품 산업에서의 활용 가치가 높을 것으로 기대된다.
요 약
백김치에서 프로바이오틱스 활성이 우수한 2종의 유산균(Limosilactobacillus fermentum SMF680과 Limosilactobacillus fermentum SMF709)을 선별하여, 생균과 열처리 사균체의 항산화 및 항염 활성을 평가하였다. 선별된 SMF680과 SMF709 균주는 상업용 프로바이오틱스 균주인 Lacticaseibacillus rhamnosus GG(LGG)와 비교하여 내산성, 내담즙성, 장부착능에서 유사한 결과를 나타내었다. SMF680과 SMF709의 생균과 사균체는 1 mg/mL 농도에서 장세포(HT-29)와 대식세포(RAW 264.7)에 대해 독성을 나타내지 않아 안전성이 확인되었다. SMF680과 SMF709 사균체는 LGG 사균체보다 항산화 활성(DPPH 라디칼 소거능, ABTS 라디칼 소거능, ß-carotene bleaching 억제능)이 유의적으로 높았다(p<0.05). 또한 SMF680과 SMF709 사균체는 생균과 비교했을 때도 ABTS 라디칼 소거능과 ß-carotene bleaching 억제능이 유의적으로 높은 것이 확인되었다(p<0.05). SMF680와 SMF709의 생균 또는 사균체 처리에 의해 LPS로 자극된 RAW 264.7 대식세포에서 TNF-α, IL-6, iNOS, COX-2의 발현이 유의적으로 억제되었다(p<0.05). SMF680와 SMF709의 생균과 사균체는 LGG의 생균과 사균체보다 TNF-α, IL-6, iNOS, COX-2의 발현 억제 활성이 우수하였으며, 특히 SMF709 사균체는 IL-6, iNOS, COX-2의 발현을 각각 73.86%, 81.93%, 65.75% 억제하여 가장 우수한 항염 효과를 보였다. 따라서 본 연구 결과, L. fermentum SMF680과 L. fermentum SMF709 균주의 열처리 사균체는 식품, 제약 및 화장품 산업에서 천연 항산화제 및 항염제로 활용 가능할 것으로 기대된다.







