Research Article
박테리오신 생산 Lactococcus lactis CJNU 3001 균주의 Clostridioides difficile 억제능
이호진
1,†
, 홍예빈
1,†
, 이재혁
1
, 문기성
1,*
Control of Clostridioides difficile by Bacteriocin-Producing Lactococcus lactis CJNU 3001
Ho-Jin Lee
1,†
, Ye-bin Hong
1,†
, Jae-Hyuk Lee
1
, Gi-Seong Moon
1,*
1Department of Biotechnology, Korea National University of Transportation, Jeungpyeong 27909, Republic of Korea
† These authors are equally contributed to this work.
*Corresponding author : Gi-Seong Moon, Department of Biotechnology, Korea National University of Transportation, Jeungpyeong 27909, Republic of Korea, Tel: +82-43-820-5251, E-mail:
gsmoon@ut.ac.kr
Copyright © Korean Society for Lactic Acid Bacteria and Probiotics. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jun 07, 2024; Revised: Jun 19, 2024; Revised: Jun 22, 2024; Accepted: Jun 22, 2024
Published Online: Jun 30, 2024
Abstract
This study sought to confirm the inhibitory ability of Clostridioides difficile KCTC 5009 strain using the bacteriocin-producing Lactococcus lactis CJNU 3001 strain. For this purpose, bacterial culture and partially purified bacteriocin verified the antibacterial activity against C. difficile strain. As a result, both samples showed strong antibacterial activity against the target strain. Co-culture tests were performed to more closely analyze the competition between the two strains. As a result, a similar inhibitory effect was confirmed in RCM broth and CMM (colon model medium) broth. In particular, inhibition of C. difficile KCTC 5009 strain was not observed until the exponential phase of the growth of L. lactis CJNU 3001 strain, because bacteriocins were produced during that period. It was inferred that it actively suppressed the growth of the target strain after that. Therefore, as it was proven that the bacteriocin-producing L. lactis CJNU 3001 strain can effectively control C. difficile strain in co-cultures, it was judged that it could be an alternative for CDI (Clostridioides difficile infection) treatment.
Keywords: Lactococcus lactis; Clostridioides difficile; CDI; bacteriocin; co-culture
서 론
Clostridioides difficile은 그람양성, 포자 형성, 혐기성 간균으로 인간과 동물의 장관 및 환경에 널리 분포되어 있다(Czepie et al., 2019). CDI (Clostridioides difficile infection)는 C. difficile에 의한 감염증으로 발병하는 경우 경미한 설사부터 대장염 및 패혈증까지 다양한 증상을 보인다(Owens, 2007). 대부분의 CDI는 항생제 치료를 우선적으로 진행하는데 이로 인해 정상적인 장내 균총이 파괴되고 C. difficile 포자의 발아가 진행되어 이들의 증식을 유발한다(Aktories et al., 2017). 항생제 반코마이신 (vancomycin)은 CDI 치료에 효과적이었으나 비용 문제 및 반코마이신 내성 장구균(VRE, vancomycin-resistance enterococci)의 확산 우려로 메트로니다졸(metronidazole)이 1차 치료제로 사용되고 있다(Musher, 2005). 그러나 재발성 CDI의 경우 항생제 치료 실패율이 높은 경향을 보이고(van Nood et al., 2013) CDI 발병률의 증가에 따라 재발율도 증가하는 추세이다(Bakken et al., 2011). CDI 초기 감염이 치료된 후 환자의 약 19~20%에서 증상이 재발한 것으로 나타나며(Aslam et al., 2005), 재발을 경험한 환자를 대상으로 재발 위험도를 수치화 했을 때 44.8%로 나타난다(McFarlandet et al., 2002).
최근에는 이러한 재발성 CDI를 치료하기 위하여 분변이식(fecal microbiota transplantation; FMT) 시술이 활용되고 있다. 분변이식은 건강한 사람의 미생물 군집을 환자에게 도입함으로써 미생물군 구성과 기능을 정상화하는 것을 말한다(Bénard et al., 2022). 실제 분변이식 시술을 시행한 환자의 경우 약 90%에서 치료 효과를 보이고 있다(Hvas et al., 2019). 하지만 그 시술의 역사가 오래되지 않은 만큼 규제 표준이 확립되지 않았고 사용 접근성도 떨어진다(Merrick et al., 2020). 또한, 장기적인 관점에서 부작용에 대한 확신이 없고, 기증자, 샘플 수집 방법 등에 대한 명확한 기준 제시가 부재하여 분변이식의 활용성을 떨어뜨린다(Wynn et al., 2023).
그러므로 CDI 치료에 있어서 새로운 접근법이 필요하다. 박테리오신(Bacteriocin) 생산 유산균 프로바이오틱스도 CDI 치료를 위한 대안이 될 수 있다. 박테리오신은 다른 박테리아와의 경쟁에서 우위를 점하기 위해 박테리아로부터 분비되는 천연의 항균성 펩타이드(Elayaraja et al., 2014)로, 단백질 가수분해효소에 의해 쉽게 분해되어 인체 잔류성이 없으며 pH와 열에 대한 안전성이 높은 특성을 가지고 있다(Lee, 1999). 본 연구는 선행연구에서 박테리오신 생산이 확인된 김치 유래의 Lactococcus lactis CJNU 3001 균주를 활용한 C. difficile균주의 제어효과를 검증하고자 하였다(Yang and Moon, 2018).
재료 및 방법
사용 균주
본 연구에 사용된 박테리오신 생산 유산균주인 L. lactis CJNU 3001 균주는 선행연구에서 김치로부터 분리되었다(Yang and Moon, 2018). L. lactis CJNU 3001 균주는 MRS(de Man, Rogosa and Sharpe; BD, Sparks, MD, USA) broth에서 정치배양하였다. C. difficile KCTC 5009 균주는 한국생명공학연구원 생물자원센터(Korean Collection for Type Cultures; KCTC)로부터 분양 받아 사용하였으며RCM(Reinforced Clostridial Medium; BD) broth에서 혐기적으로 배양하였다. 혐기배양장치는 Don Whitley Scientific 사(Bingley, UK)의DG250 모델을 사용하였다.
C. difficile 균주에 대한 L. lactis 균주의 항균 활성
C. difficile KCTC 5009 균주에 대한 L. lactis CJNU 3001 균주의 항균 활성을 확인하기 위하여 한천확산법(Daeschel, 1992)을 이용하였다. 즉, RCM 고체배지 위에 L. lactis CJNU 3001 균주 배양액 2 μL를 점적하여 혐기적인 조건에서 37°C, 12시간 배양 후 그 위에 C. difficile KCTC 5009 균주 배양액이 2% 접종된 RCM soft agar(1.2% agar, w/v) 6 mL를 붓고 혐기적인 조건에서37℃, 24시간 배양한 후 콜로니 주변에 생육저해환이 형성되었는지를 확인하였다.
박테리오신 부분 정제 및 항균작용 양상
L. lactis CJNU 3001 균주가 생산하는 박테리오신의 부분정제를 위해서 아세톤 추출법(Chung et al., 2011)을 일부 수정하여 사용하였다. 즉, 균주 배양액을 원심분리(4°C, 7,155 g, 10분)한 후 상등액을 회수하여 NaOH로 pH를 7.0으로 조정 후 제균 여과하였다(0.22 μm membrane filter; Agela Technologies, Tianjin, China). 이를 동결건조한 후 최소량의 멸균수에 현탁하고 아세톤(물 : 아세톤=1:3)을 첨가하였다. 이후 –20°C에서 3시간 동안 정치하면서 30분 간격으로 섞어 주었다. 이를 원심분리(4°C, 9,000 g, 20분)한 후 불용성의 중간층을 회수하여 멸균수에 현탁해 부분정제 박테리오신 용액으로 사용하였다.
부분 정제된 박테리오신의 활성 측정을 위하여 상기의 한천확산법을 이용하였고 시료를 단계적으로 2배씩 희석한 후 C. difficile KCTC 5009 균주가 분주된 고체배지 위에 2 μL씩을 점적하였으며 혐기배양장치에서 하룻밤 배양을 진행하였다. 박테리오신 활성은 임의 단위(AU/mL)를 사용하여 나타냈으며 이는 생육저해환을 보이는 최대 희석배수의 역을 취하고 1 mL에 대한 환산계수(500)를 곱한 값이다(Daeschel, 1992).
부분 정제된 박테리오신의 C. difficile KCTC 5009 균주에 대한 항균 작용 양상을 확인하기 위하여 1/10 RCM 액체배지(정상적인 배지 성분의 10%만 첨가)에 하룻밤 배양한 C. difficile KCTC 5009 균주 1%를 접종하고 각각 최종농도 2.5, 5.0 AU/mL의 박테리오신 용액을 첨가하였다. 이를 혐기배양장치에서 배양하면서 경시적으로(0, 3, 6시간) 생균수를 측정하였다.
L. lactis 균주와 C. difficile 균주의 경쟁
L. lactis CJNU 3001 균주와 C. difficile KCTC 5009 균주의 경쟁을 분석하기 위하여 RCM broth와 CMM(colon model medium) broth를 사용하였다. CMM broth는 Day-Walsh 등의 방법을 일부 변경하여 제조하였다(Day-Walsh et al., 2021). 즉, 증류수 1 L 기준으로 peptone water 2 g, yeast extract 2 g, NaCl 0.1 g, K2HPO4 0.04 g, KH2PO4 0.04 g, MgSO4·7H2O 0.01 g, CaCl2·2H2O0.01 g, NaHCO32 g, Tween 80 2 mL, Vitamin K1 10 μL, cysteine·HCl 0.5 g, Bile salts 0.5 g, Hemin 0.02 g, glucose 10 g이 포함되었다. 각각의 균주 배양액을 멸균수로 2회 세척한 후 RCM broth와 CMM broth 5 mL에 1%씩 동시 접종하였다. 이후 37℃에서 혐기배양하면서 경시적으로(0, 3, 6, 9, 12, 18, 24시간) 생균수를 측정하였다. L. lactis CJNU 3001 균주선택배지로는 MRS 고체배지를 사용하였고 C. difficile KCTC 5009 균주의 선택배지로는 RCM 고체배지에 항생제D-Cycloserine(Sigma-Aldrich, St. Louis, MO, USA) 250 μg/mL, Cefoxitin sodium salt(Sigma-Aldrich) 8 μg/mL를 첨가하여 사용하였다.
통계처리
논문에 기술된 모든 실험은 3회 반복실험으로 진행하여 평균±표준편차로 나타냈으며, SPSS ver. 25(Statistical Package for Social Sciences, SPSS Inc., Chicago, IL, USA)를 통계분석에 이용하였다. 일원분산분석(one-way ANOVA)으로 유의성을 검증하였으며, Tukey HSD(p<0.05)로 사후검정하였다.
결과 및 고찰
C. difficile 균주에 대한 L. lactis 균주의 항균 활성
L. lactis CJNU 3001 균주의 C. difficile KCTC 5009 균주에 대한 항균활성을 한천확산법으로 확인한 결과, L. lactis CJNU 3001 균주 콜로니 주변에서 깨끗한 생육저해환이 나타나 L. lactis CJNU 3001 균주가 생산하는 박테리오신에 의한 영향인 것으로 추정되었다(Fig. 1A). L. lactis CJNU 3001 균주는 박테리오신 외에도 젖산을 생성하기 때문에 산에 의한 저해도 배제할 수는 없지만 일반적으로 산에 의한 저해는 경계 부분이 흐릿한 특성을 나타낸다(Han and Moon, 2020). 또한 부분 정제된 박테리오신을 점적한 경우에도 생육저해환이 뚜렷하게 나타나 C. difficile KCTC 5009 균주는 L. lactis CJNU 3001 균주가 생산하는 박테리오신에 민감한 것으로 확인되었다(Fig. 1B).
Fig. 1.
Antimicrobial activity of Lactococcus lactis CJNU 3001 against Clostridioides difficile KCTC 5009. A: bacterial culture; B: partially purified bacteriocin.
Download Original Figure
박테리오신 부분 정제 및 항균작용 양상
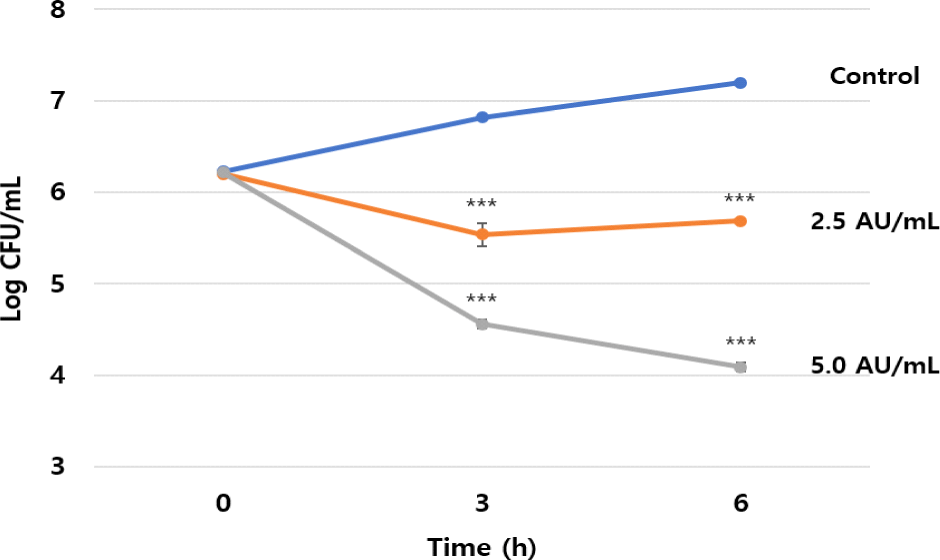
L. lactis CJNU 3001 균주로부터 생산되는 박테리오신을 부분 정제하기 위해서 아세톤 추출법을 이용하였으며 추출 및 활성 분획한 결과 중간층에서 박테리오신 활성이 확인되었다. 또한 박테리오신 부분 정제액의 활성을 측정한 결과 8,000 AU/mL로 나타났다. 이를 이용하여 L. lactis CJNU 3001 균주가 생산하는 박테리오신의 C. difficile KCTC 5009 균주에 대한 항균작용 양상을 확인한 결과 살균기작(bacteriocidal action mode)을 나타내었다. 즉, 박테리오신 무첨가구의 경우 경시적으로(0, 3, 6시간) C. difficile KCTC 5009 균주의 균수는 각각 6.22, 6.82 및7.20 log CFU/mL로 증가한 반면, 박테리오신 2.5 AU/mL 첨가구의 경우 각각 6.21, 5.54 및 5.69 log CFU/mL를 나타내었고, 박테리오신 5.0 AU/mL 첨가구의 경우 각각 6.21, 4.56 및 4.09 log CFU/mL를 나타내어 농도의존적 생균수 감소가 확인되었다(Fig. 2). 예비실험의 결과 10 AU/mL 이상이 사용되었을 때 시작 시점부터 생균이 검출되지 않았다(data not shown). 이는 L. lactis CJNU 3001 균주가 생산하는 박테리오신이 C. difficile KCTC 5009 균주에 대하여 우수한 항균활성을 나타냄을 확인할 수 있다.
Fig. 2.
Antimicrobial action mode of partially purified bacteriocin from Lactococcus lactis CJNU 3001 against Clostridioides difficile KCTC 5009. ***p<0.001 vs. control.
Download Original Figure
L. lactis 균주와 C. difficile 균주의 경쟁
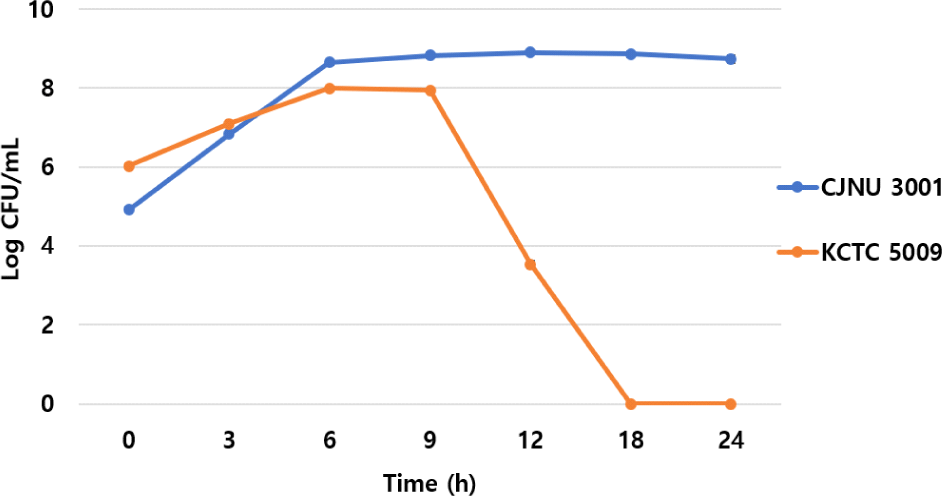
RCM 액체배지에서 두 균주를 경쟁시킨 결과, L. lactis CJNU 3001 균주의 경우 0-6시간까지 빠르게 증식(4.91 → 8.65 log CFU/mL)을 하고 이후 유지되는 양상을 보였다. 반면, C. difficile KCTC 5009 균주의 경우 0-6시간까지 완만한 증식속도(6.02 → 8.00 log CFU/mL)를 보이다가 9시간(7.94 log CFU/mL)까지 생균수가 유지된 후 이후 급속도로 감소하는 양상을 보였으며 18시간 이후에는 생균수 확인이 불가하였다(Fig. 3). 이는 L. lactis CJNU 3001 균주의 증식과정에서 생산된 박테리오신 및 유기산 등이 복합적으로 영향을 미친 것으로 추론되었다.
Fig. 3.
Viable cell counts of Lactococcus lactis CJNU 3001 and Clostridioides difficile KCTC 5009 in a co-culture (RCM broth).
Download Original Figure
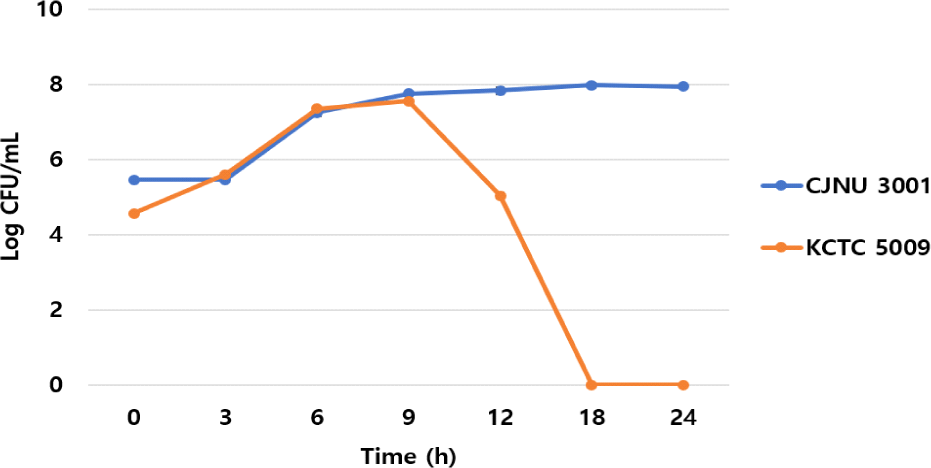
CMM 액체배지에서도 비슷한 양상이 확인되었다. L. lactis CJNU 3001 균주의 경우 0-9시간까지 빠르게 증식(5.46 → 7.74 log CFU/mL)을 하고 이후 생균수가 유지되는 양상을 보였다. 반면, C. difficile KCTC 5009 균주의 경우 0-6시간까지 급격한 증식속도(4.56 → 7.35 log CFU/mL)를 보이다가 9시간(7.55 log CFU/mL)까지 생균수가 유지된 후 급속도로 감소하는 양상을 보였으며 18시간 이후에는 생균수 확인이 불가하였다(Fig. 4). 이는RCM 액체배지와 마찬가지로 CMM 액체배지에서도 L. lactis CJNU 3001 균주의 증식과정에서 생산된 박테리오신 및 유기산 등이 복합적으로 영향을 미친 것으로 추론되었다.
Fig. 4.
Viable cell counts of Lactococcus lactis CJNU 3001 and Clostridioides difficile KCTC 5009 in a co-culture (CMM broth).
Download Original Figure
CDI 치료에 사용되는 메트로니다졸, 반코마이신 등은 역설적으로 정상적인 장내 미생물 군집을 파괴하기 때문에 CDI 악화 및 재발에 기여한다(Culligan and Sleator, 2016). 따라서 비항생제 대체 치료법 개발이 시급한 실정이다. 마이크로바이옴 기반의 FMT가 현재 광범위하게 시술되고 있고 프로바이오틱스 또한 CDI 치료를 위한 항생제 대체재로서 많은 연구가 수행되고 있다. 특히, 프로바이오틱스는 균종 혹은 균주에 따라 효과에 차이가 있고 단독으로 사용하기 보다는 항생제 보조제로 사용되었을 때 그 효과가 우수한 것으로 확인되었다(Evans and Johnson, 2015; Maziade et al., 2015). 박테리오신은 다양한 박테리아가 생산하는 항균성 펩타이드로 항생제 내성 병원성 세균 제어를 위한 항생제 대체재로서 활발한 연구가 진행되고 있다(Culligan and Sleator, 2016). 특히, 인체에 안전한 프로바이오틱스 균주가 생산하는 박테리오신에 대한 관심이 증대되고 있고 C. difficile 제어를 위한 연구도 활발하다. C. difficile 제어를 위한 대표적인 박테리오신은 나이신(nisin)이다. C. difficile을 인위적으로 접종한(106 CFU/mL)분변시료에 나이신을 농도별로 처리한 결과 50-500 μM 농도에서 C. difficile의 생균이 관찰되지 않았다(O'Reilly et al., 2022). 이는 나이신을 이용하여 장내 감염된 C. difficile을 효과적으로 제어할 수 있음을 시사한다. 또한 기존의 항생제인 반코마이신 및 메트로니다졸과의 비교에서도 나이신은 C. diffcile 생육 저해를 위한 최소저해농도(MIC, minimum inhibitory concentration, μg/mL)에서 가장 낮은 값을 보여 두 항생제에 비해 저해효과가 우수하였다(Bartoloni et al., 2004). 본 연구에 사용한 L. lactis CJNU 3001 균주가 생산하는 박테리오신도 나이신으로 추정되며 상기의 결과들은 CDI 치료에 L. lactis CJNU 3001 균주가 사용될 수 있음을 시사한다. 다만, 실제 장내 환경에서 L. lactis CJNU 3001 균주가 증식하여 C. difficile 균주의 생육 억제를 위한 충분한 양의 박테리오신을 생산할지에 대한 의문점이 있다. 이러한 in vitro 실험의 한계점을 극복하기 위하여 향후 in vivo 실험을 통한 효과 검증이 이루어져야 한다.
요 약
본 연구는 박테리오신 생산 Lactococcus lactis CJNU 3001 균주를 활용한 Clostridioides difficile KCTC 5009 균주의 억제능을 확인하고자 하였다. 이를 위해 균주 배양액 및 부분 정제 박테리오신을 활용하여 C. difficile 균주에 대한 항균활성을 검증한 결과, 두 시료 모두 대상 균주에 대한 강한 항균활성을 나타내었다. 두 균주의 경쟁상황을 보다 면밀하게 분석하기 위하여 동시배양 시험을 수행하였다. 그 결과 RCM 액체배지 및 CMM 액체배지에서 비슷한 양상의 저해효과를 확인할 수 있었으며 특히, L. lactis CJNU 3001 균주 성장의 대수기까지는 C. difficile KCTC 5009 균주의 억제가 관찰되지 않았는데 이는 그 기간 동안에 박테리오신이 생산되고 그 이후에 목표 균주의 증식을 적극적으로 억제하는 것으로 추론되었다. 따라서, 동시배양에서 박테리오신 생산 L. lactis CJNU 3001 균주가 C. difficile 균주를 효과적으로 제어할 수 있다는 것이 증명됨에 따라 CDI 치료를 위한 대안이 될 수 있을 것으로 판단되었다.
감사의글
이 논문은 2023학년도 한국교통대학교의 해외파견 연구교수지원금을 받아 수행한 연구이며 이에 감사드립니다.
References
Aktories K, Schwan C, Jank T (2017)
Clostridium difficiletoxin biology.
Annu. Rev. Microbiol.
71, 281-307.



Aslam S, Hamill RJ, Musher DM(2005) Treatment of
Clostridium difficile-associated disease: Old therapies and new strategies.
Lancet Infect. Dis.
5, 549-557.



Bakken JS, Borody T, Brandt LJ, Brill JV, Demarco DC, Franzos MA, Kelly C, Khoruts A, Louie T, Martinelli LP, Moore TA, Russell G, Surawicz C (2011) Treating
Clostridium difficile infection with fecal microbiota transplantation.
Clin. Gastroenterol. Hepatol.9, 1044-1049.




Bartoloni A, Mantella A, Goldstein BP, Dei R, Benedetti M, Sbaragli S, Paradisi F (2004)
In-vitro activity of nisin against clinical isolates of
Clostridium difficile.
J. Chemother.16, 119-121.



Bénard MV, de Bruijn CMA, Fenneman AC, Wortelboer K, Zeevenhoven J, Rethans B, Herrema HJ, van Gool T, Nieuwdorp M, Benninga MA, Ponsioen CY (2022) Challenges and costs of donor screening for fecal microbiota transplantations.
PLoS One.17, e0276323.




Chung DM, Kim KE, Jeong SY, Park CS, Ahn KH, Kim DH, Kang DO, Chun HK, Yoon BD, Koh HB, Kim HJ and Choi NS (2011) Rapid concentration of some bacteriocin-like compounds using an organic solvent.
Food Sci. Biotechnol.20, 1457- 1459.


Culligan EP and Sleator RD(2016) Advances in the microbiome: Applications to
Clostridium difficile infection.
J. Clin. Med.5, 83.




Czepiel J, Dróżdż M, Pituch H, Kuijper EJ, Perucki W, Mielimonka A, Goldman S, Wultańska D, Garlicki A, Biesiada G (2019)
Clostridium difficile infection: Review.
Eur. J. Clin. Microbiol. Infect. Dis.38, 1211–1221.




Daeschel MA (1992) Procedures to detect antimicrobial activities of microorganisms. In Food Biopreservatives of Microbial Origin. Ray B and Daeschel MA(ed). CRC Press, FL, USA. pp. 57-80.

Day-Walsh P, Shehata E, Saha S, Savva GM, Nemeckova B, Speranza J, Kellingray L, Narbad A and Kroon PA (2021) The use of an
in-vitro batch fermentation (human colon) model for investigating mechanisms of TMA production from choline, L-carnitine and related precursors by the human gut microbiota.
Eur. J. Nutr.60, 3987-3999.




Elayaraja S, Annamalai N, Mayavu P, Balasubramanian T (2014) Production, purification and characterization of bacteriocin from
Lactobacillus murinus AU06 and its broad antibacterial spectrum.
Asian Pac. J. Trop. Biomed.4, S305-S311.




Evans CT and Johnson S(2015) Prevention of
Clostridium difficileinfection with probiotics.
Clin. Infect. Dis.60(Suppl. 2), S122–S128.



Han MH and Moon GS (2020) Development of skin health promoting materials using
Leuconostoc mesenteroides.Microbiol. Biotechnol. Lett.48, 455-462.


Hvas CL, Dahl Jørgensen SM, Jørgensen SP, Storgaard M, Lemming L, Hansen MM, Erikstrup C, Dahlerup JF (2019) Fecal microbiota transplantation Is superior to fidaxomicin for treatment of recurrent
Clostridium difficile infection.
Gastroenterology156, 1324-1332.



Lee HJ, Park CS, Joo YJ, Kim SH, Yoon JH, Park YH, Hwang IK, Ahn JS, Mheen TI (1999) Identification and characterization of bacteriocin-producing lactic acid bacteria isolated from kimchi.
J. Microbiol. Biotechnol.9, 282-291.

Maziade PJ, Pereira P, and Goldstein EJ (2015) A decade of experience in primary prevention of
Clostridium difficile infection at a community hospital using the probiotic combination
Lactobacillus acidophilus CL1285,
Lactobacillus casei LBC80R, and
Lactobacillus rhamnosus CLR2(Bio-K+).
Clin. Infect. Dis.60(Suppl. 2), S144–S147.



McFarland LV, Elmer GW, Surawicz CM (2002) Breaking the cycle: treatment strategies for 163 cases of recurrent
Clostridium difficiledisease
. Am. J. Gastroenterol.97, 1769-1775.



Merrick B, Allen L, Masirah M Zain N, Forbes B, Shawcross DL, Goldenberg SD (2020) Regulation, risk and safety of faecal microbiota transplant.
Infect. Prev. Pract.
2, 100069.




Musher DM, Aslam S, Logan N, Nallacheru S, Bhaila I, Borchert F, Hamill RJ (2005) Relatively poor outcome after treatment of
Clostridium difficile colitis with metronidazole.
Clin. Infect. Dis.
40, 1586-1590.



O'Reilly C, O'Connor PM, O'Sullivan Ó, Rea MC, Hill C and Ross RP (2022) Impact of nisin on
Clostridioides difficile and microbiota composition in a faecal fermentation model of the human colon.
J. Appl. Microbiol.132, 1397-1408.



Owens, RC (2007)
Clostridium difficile-associated disease.
Drugs67, 487–502.



van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, Visser CE, Kuijper EJ, Bartelsman JF, Tijssen JG, Speelman P, Dijkgraaf MG, Keller JJ (2013) Duodenal infusion of donor feces for recurrent
Clostridium difficile.
N. Engl. J. Med.
368, 407–415.



Yang JM and Moon GS (2018) Isolation of a
Lactococcus lactisstrain producing anti-staphylococcal bacteriocin.
Korean J. Food Sci. An.38, 1315-1321.