Research Article
김치 유래 유산균 포스트바이오틱스 분획물의 대식세포 활성화
정원비
1
, 김연숙
1
, 신현영
2
, 신지영
3
, 신광순
4
, 유광원
1,*
Macrophage Activation of Postbiotics Fractions Prepared from Lactic Acid Bacteria Isolated from Kimchi
Won Bi Jeong
1
, Yeon Suk Kim
1
, Hyun Young Shin
2
, Ji-Young Shin
3
, Kwang-Soon Shin
4
, Kwang-Won Yu
1,*
2고려대학교 대학원 의생명융합과학과 러닝헬스시스템융합전공
1Major in Food and Nutrition, Korea National University of Transportation, Chungbuk 27909, Republic of Korea
2Transdisciplinary Major in Learning Health System, Department of Integrated Biomedical and Life Science, Korea University Graduate School, Seoul 02841, Republic of Korea
3Cosis-Bio Co., Ltd., Jincheon 27867, Republic of Korea
4Department of Food Science and Biotechnology, Kyonggi University, Suwon 16227, Republic of Korea
*Corresponding author : Kwang-Won Yu, Major in Food and Nutrition, Korea National University of Transportation, Chungbuk 27909, Republic of Korea, Tel:+82-43-820-5333, Fax:+82-43-820-5850, E-mail:
kwyu@ut.ac.kr
Copyright © Korean Society for Lactic Acid Bacteria and Probiotics. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Apr 22, 2024; Revised: May 25, 2024; Accepted: Jun 10, 2024
Published Online: Jun 30, 2024
Abstract
To suggest the development possibility of immunostimulating materials from lactic acid bacteria (LAB) postbiotics, Lactobacillus sakei/Leuconostoc mesenteroides were isolated from Kimchi. Next, two isolated LAB were cultured to prepare postbiotics (LABP) to measure macrophage activity. LABP significantly increased the production of macrophage stimulating factors such as nitric oxide, tumor necrosis factor-α, and interleukin-6. LABP-crude polysaccharides (CP) fractionated from LABP by EtOH precipitation not only showed more potent macrophage stimulating activity but also induced phagocytic activity in a dose-dependent manner. In addition, LABP-CP was identified as polysaccharides with a major monosaccharide composition of mannose (59.1%), glucose (23.0%), and galactose (14.0%) with high-molecular-weight of 103.5~126.7 kDa. In conclusion, postbiotics prepared from LAB isolated from Kimchi were confirmed to have industrial applications as a functional material with immunostimulating activity.
Keywords: lactic acid bacteria; postbiotics; Kimchi; macrophage activation; polysaccharides
서 론
COVID-19 팬데믹을 기점으로 건강에 대한 인식이 질병의 치료에서 예방과 건강 유지로 변화함에 따라 스스로의 건강관리를 위해 투자를 아끼지 않는 셀프메디케이션(self-medication) 트렌드가 확산하고 있다(Kim 등, 2023c; Lee 등, 2024). 이와 같은 트렌드의 확산으로 국내 건강기능식품 시장은 꾸준한 성장세를 보이고 이와 관련한 제조 품목이 세분화 및 다양화되며 특히, 면역력 및 장 건강과 밀접하게 관련된 프로바이오틱스 시장이 활성화되고 있는 것으로 알려져 있다(Hong, 2023; Kim 등, 2023a). 프로바이오틱스(probiotics)란 적당량 섭취했을 때 숙주의 건강에 유익한 역할을 하는 미생물로 장내 균총의 안정화, 변비 개선 및 면역 활성화 등의 기능을 한다고 보고되고 있다(Seo 등, 2019). 그러나, 프로바이오틱스는 위장관에 존재하는 위산 혹은 담즙산을 견뎌야 온전한 역할을 수행할 수 있다는 단점이 있으며(Williams, 2010), 이러한 단점을 보완할 수 있는 미생물 유래 기능성 소재로서 포스트바이오틱스에 대한 관심이 높아지고 있다(Żółkiewicz 등, 2020). 포스트바이오틱스는 숙주의 건강에 유익한 미생물의 살아 있지 않은 형태 또는 그 대사산물이 포함된 제형(Salminen 등, 2021)으로 위산과 담즙산에 덜 영향을 받고 장까지 이동하여 장내 유해균을 억제할 수 있으며 장을 보호하는 역할을 한다고 알려져 있다(Hong, 2023). 이 밖에도 병원체에 대한 길항효과 및 항종양 효과 등(Aguilar-Toalá등, 2018)의 효능이 있으며 장의 장벽기능 및 점막 면역을 강화하여 면역질환을 예방하는 기능을 수행한다(Liang 와Xing, 2023). 프로바이오틱스에 비해 비교적 안전성이 우수한 소재로서 포스트바이오틱스의 개발은 미생물 소재로서 건강기능식품 소재화에 대해 질병의 예방과 건강 유지의 측면에서 중요한 역할을 할 것으로 사료된다.
대표적으로 포스트바이오틱스에 이용되는 원료인 유산균은 영양학적으로 장염 조절 및 유당 소화 개선 등의 이점이 있으며(Gilliland, 1990), 최근에는 발효식품에서 분리된 유산균을 의미하는 식물성 유산균(plant-originated lactic acid bacteria; POLAB)에 대해 다양한 연구가 진행 중인 것으로 알려져 있다(Sung 등, 2022). POLAB는 영양소를 활용하여 새로운 대사산물의 생성을 통해 항균을 포함한 다양한 약리적 효능이 보고되고 있다(Lim 등, 2018). 우리나라의 전통 발효식품인 김치는 다양한 미생물의 상호작용을 통해 발효되며(Park, 2017), 대표적인 김치 유래 POLAB는 Leuconostoc mesenteroides와 Lactobacillus plantarum 등이 존재한다(Jang 와Kim, 2013). 이러한 POLAB는 항돌연변이(Song 등, 2015), 항암(Park 등, 2014), 항산화(Kim 등, 2020), 항노화(Park , 2012), 항비만(Park 와Hong, 2019), 항동맥경화(You 등, 2013) 및 면역력 강화(Kim 등, 2023b) 등의 효능이 보고되고 있으며, POLAB을 통해 조제된 포스트바이오틱스 또한 면역력 증진 등 다양한 효능이 보고되고 있다(Kim 등, 2022; Kim 등, 2024).
Kim 등(2022) 및 Kim 등(2024)은 시판 김치로부터 분리 및 동정한 POLAB(Lactobacillus sakei 및 Leuconostoc mesenteroides)를 생약 등 천연물에 발효시킴으로써 생리활성의 증진을 유도하였다. 그러나 유산균 자체로부터 제조된 포스트바이오틱스의 생리활성에 미치는 영향은 제시하지 않았기에, 본 연구에서는 유산균 배양액의 추출 및 분리 과정을 거쳐 POLAB 유래 포스트바이오틱스의 면역 활성 기능성 소재로의 활용 가능성을 확인하고자 하였다.
재료 및 방법
김치 유래 유산균 포스트바이오틱스 및 분획물 제조
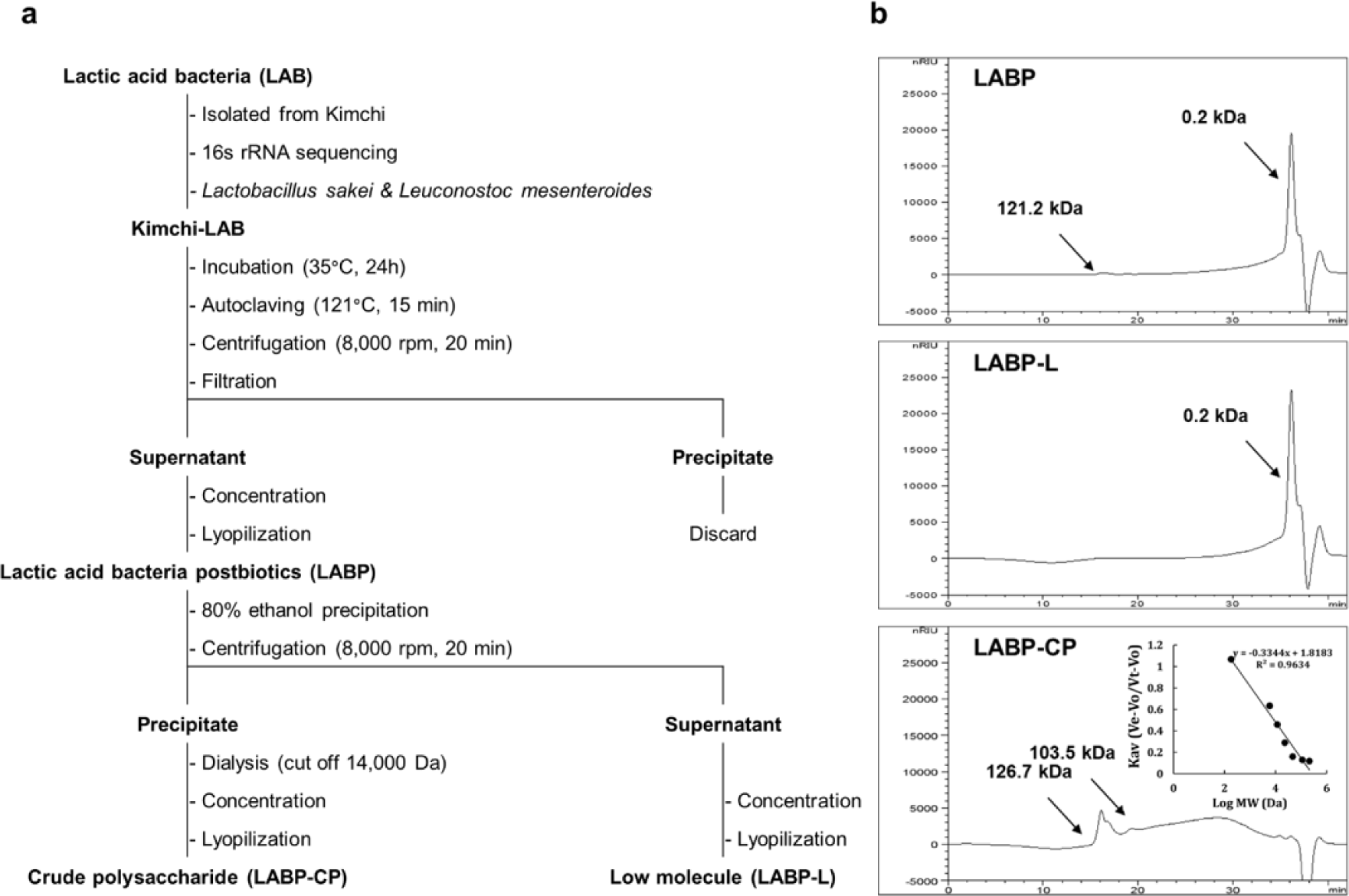
본 연구에서 이용된 김치 유래 유산균은 ㈜코시스바이오(Jincheon, Korea)에서 Kim 등(2022)이 시판 김치로부터 Lactobacillus sakei 및 Leuconostoc mesenteroides를 분리 및 동정하였으며, 이들을 MRS broth에 1 ×107CFU/mL로 조정하여 35°C에서 24시간 공동배양한 후 121°C에서 15분간 멸균하고 원심분리(8000 rpm, 4°C, 20 min, 2236R, LABOGENE, Korea)하여 침전물과 상등액으로 분리하였다. 다음으로 분리한 상등액은 여과(Advantec, Tokyo, Japan), 농축 및 동결건조하여 김치 유산균 유래 포스트바이오틱스(lactic acid bacteria postbiotics; LABP)로 제조했다. 또한, LABP는 40 g을 증류수 150 mL에 용해한 후 95% 주정 5배(w/v)를 첨가하여 충분히 교반하고 원심분리(8,000 rpm, 4°C, 20 min)로 침전물과 상등액을 분리한 후 침전물은 투석(MWCO 12-14 kDa, Spectra/PorTM, SpectrumLab. Inc., RanchoDominguez, CA, USA), 농축 및 동결건조하여 김치 유래 유산균 포스트바이오틱스의 조다당 획분(crude polysaccharide; LABP-CP)으로, 상등액은 농축 및 동결건조하여 김치 유래 유산균 포스트바이오틱스의 저분자 획분(low molecule; LABP-L)으로 각각 분획하였다(Fig. 1a).
Fig. 1.
Fractionation scheme of postbiotics (LABP) by lactic acid bacteria (a). Molecular weight distribution of postbiotics fractions (LABP-L and -CP) by lactic acid bacteria (b).
Download Original Figure
RAW 264.7 세포주를 이용한 대식세포 자극활성
본 실험에 사용된 RAW 264.7 세포주는 한국세포주은행(Koean Cell Line Bank, KCLB, Seoul, Korea)에서 입수하였으며 배양에 이용된 배지는 Dulbecco’s modified Eagle medium (DMEM; Hyclone, San Angelo, TX, USA)에 10% fatal bovine serum(FBS; Gibco, Waltham, MA, USA)과 1% penicillin/ streptomycin(GenDEPOT, Katy, TX, USA)을 첨가하여 37°C 및 5% CO2 조건 하에서 배양하였다. 대식세포 자극활성을 평가하기 위해 RAW 264.7 세포주를 2.0×106cells/mL로 96 well plate에 각 180 µL씩 분주하여 3시간 배양한 후 일정한 농도로 희석한 시료를 각각 20 µL씩 처리하여 24시간 동안 배양하였다. RAW 264.7 세포주로부터 생성된 산화질소(nitric oxide; NO)의 함량은 Griess assay(Tursun 등, 2016)를 이용하여 sodium nitrate을 통해 표준곡선을 작성한 뒤 함량을 µM로 나타냈다. 대식세포 자극 인자인 tumor necrosis factor(TNF)-α 및 interleukin(IL)-6는 각각 Invitrogen(Carlsbad, CA, USA) 및 BD Bioscience(San Diego, CA, USA)에서 구입한 enzyme- linkage immunosorbent assay(ELISA) kit로 분석하였고, 각 제조사에서 제공된 recombinant protein을 활용하여 표준곡선을 작성한 후 함량을 ng/mL로 나타냈다.
RAW 264.7 세포주를 이용한 식세포 활성
RAW 264.7 세포주를 48 well plate에 2.5×105cells/mL로 각각 250 µL씩 분주하여 3시간 동안 배양한 뒤 각 시료를 250 µL씩 처리하여 24시간 동안 배양하였다. 이후 PBS에 용해된 0.0375% neutral red(Duksan chemical; Ansan, Korea) 용액을 처리하여 암실에서 30분간 반응시켰다. 이후, lysis buffer를 처리하여 30분간 반응시킨 후 540 nm의 흡광도에서 측정하였으며, 식세포 활성은 시료 무처리군(negative control; NC)에 대한 백분율로 표기하였다.
분자량 분포
분자량 분포는 high performance size exclusion chromatography (HPSEC)로 평가하였다. 적절한 농도로 희석한 시료를PVDF membrane filter로 여과하고 Table 1과 같은 조건으로 분석을 진행하였다. 표준물질은 galactose (Gal; Sigma Aldrich) 및 다양한 분자량의 pullulan (Shodex, Tokyo, Japan)을 이용하였고, retention time (RT)을 통해 표준곡선을 작성한 후 회귀시료 간의 RT을 비교하여 kDa으로 계산하였다.
Table 1.
HPLC operating conditions for determining molecular weight distribution and sugar composition
|
Analysis |
Molecular weight distribution |
Sugar composition |
|
Instrument |
Agilent 1260 series (AgilentTechnologies,Inc., USA) |
Ultimate 3000 (Dionex, Germany) |
|
Detector |
Refractive index |
UV at 254 nm |
|
Column |
SuperdexTM 75 GL column (10×300 mm,GEHealthcare,USA) |
YMC-Triart C18 (250×4.6 mm, 5 µm, YMCCo., Ltd., Japan) |
|
Column temperature |
Room temperature (R.T) |
30°C |
|
Flow rate |
0.5 mL/min |
1.0 mL/min |
|
Mobile phase |
50 mM ammonium formate buffer (pH 5.5) |
0.1 M sodium phosphate buffer (pH 6.7): acetonitrile(82:18) |
|
Injection volume |
20 µL |
20 µL |
|
Data calculator |
Chemstation |
Chromeleon 7 |
Download Excel Table
구성분 및 구성당 분석
중성당, 산성당 및 단백질 함량은 각각 glucose(Glc; Sigma Aldrich, St. Louis, MO, USA)를 표준물질로 이용하여 phenol- sulfuric acid법(DuBois 등, 1956), glucuronic acid (Glc A; Sigma Aldrich)를 이용하여 m-hydroxybiphenyl 법(Blumenkrantz와 Asboe-Hansen, 1973) 및 bovine serum albumin (BSA)를 이용하여 Bradford(1976)의 방법으로 분석하였으며, w/w%로 나타냈다. 구성당 분석은 Honda 등(1989) 및 Shin 등(2021)의 방법을 참고하여 시료에 2 M trifluoroacetic acid(TFA; Sigma Aldrich)를 처리하여 aldose 단위로 분해하였다. 이후 0.3 M NaOH와 1-phenyl-3-methyl-5-pyrazoline (PMP; Sigma Aldrich)을 첨가하여 단당류와 PMP를 결합시킨 유도체로 전환시키고 0.3 M HCl을 가하여 중화하였다. 이후, 증류수 및 chloroform(2상 용매계)으로 분리 및 추출한 후 물 층만 분리하여 PVDF membrane filter(0.45 µm, Jaema Trade Inc., Gwangwon, Korea)로 여과하고 HPLC로 분석을 진행하였다. HPLC 분석조건은 Table 1에 나타냈으며, 분석 결과는 peak area와 response factor를 이용하여 mole %로 계산하였다.
통계처리
모든 시험은 3번 반복하여 분석하였고 결과는 평균±표준편차(standard deviation; SD)로 나타냈다. RAW 264.7의 대식세포 자극 활성 및 식세포 활성의 분석결과는 SPSS V26(SPSS Inc., Chicago, IL, USA)을 이용한 Student’s t-test로 계산하여 각각 p<0.05, p<0.01 및 p<0.001 수준에서 유의성을 검증하였다. 또한, 구성분 분석의 경우, 성분간 유의성 평가를 위해 분산분석(analysis of variance; ANOVA)을 실시하여 각 측정값 간의 유의성을 Duncan's multiple range test로 p<0.05 수준에서 검증하였다.
결과 및 고찰
김치 유래 유산균 포스트바이오틱스의 대식세포 자극 활성
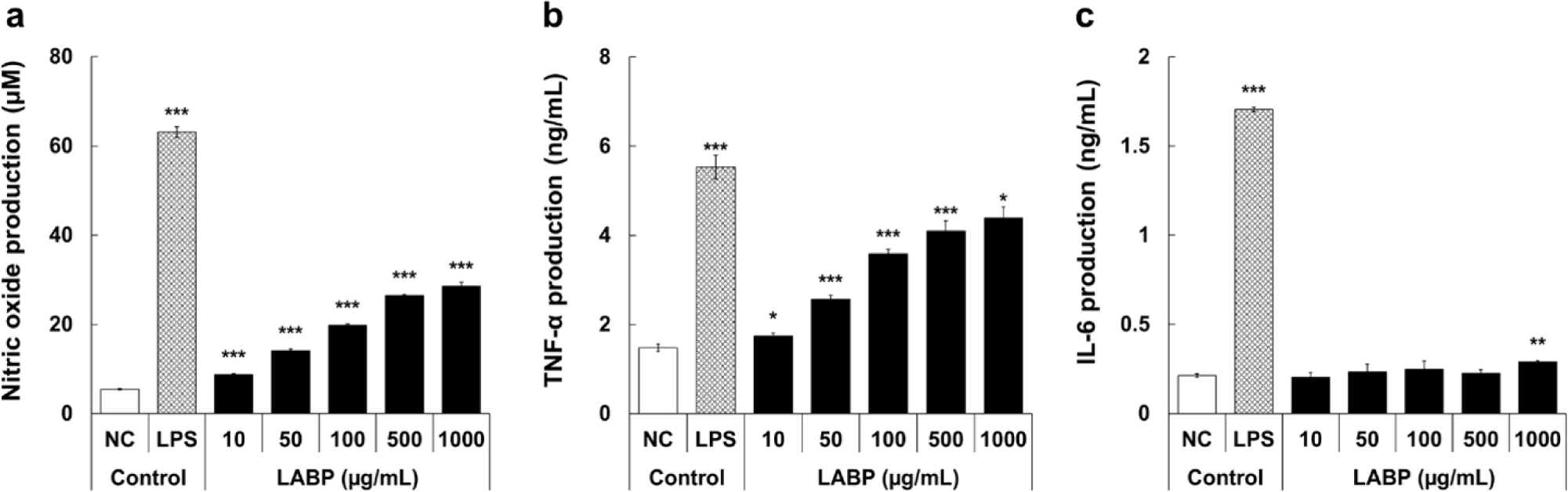
대식세포는 선천면역을 대표하는 면역 세포로 외부 병원체에 대해 즉각적인 방어를 제공하고 백혈구 침투를 조정함으로써 항상성과 방어에 핵심적인 역할을 하는 것으로 알려져 있다(Martinez 등, 2008). 또한, 대식세포는 세포간 통신을 중개하여 면역 반응을 조절하는 단백질인 사이토카인의 생성을 매개하는 것으로 알려져 있다(Arango Duque 와 Descoteaux, 2014). 따라서, 본 연구에서는 김치 유래 유산균을 이용하여 조제한 포스트바이오틱스(LABP)의 처리에 따른 대식세포 활성화 인자인 NO, TNF-α 및 IL-6 생성능을 평가하였다. 대식세포에서 사이토카인의 분비를 촉진해 면역 반응을 유도한다고 알려진 NO의 생성능을 평가한 결과(Fig. 2a), 양성 대조군으로 활용된 LPS 처리군은 1 µg/mL의 농도에서NC 대조군(5.5 µM) 대비 63.1 µM(11.6배 증가)의 생성능을 확인할 수 있었으며, LABP는 10~1000 µg/mL의 농도에서 8.7~28.6 µM(1.6~5.2배 증가)의 농도-의존적인 NO 생성량을 보였다. 또한, 암세포의 직접적인 세포 용해를 유도해 항암작용을 나타내는 TNF-α의 생성능을 확인한 결과(Fig. 2b), 10~1,000 µg/mL의 농도 범위에서 NC 대조군(1.5 ng/mL)에 비하여 1.7~4.4 ng/mL (1.2~3.0배 증가)의 농도-의존적인 생성능을 나타내는 것으로 확인되었다. 다음으로, 면역 세포인 B 세포 분화를 활성화하는 인자인 IL-6의 생성능을 확인한 결과(Fig. 2c), 1000 µg/mL의 농도에서만 NC 대조군(0.2 ng/mL)과 비교하여 0.3 ng/mL(1.4배 증가)로 유의적인 생성능을 보였다. Hur 등(2004)의 연구에서 김치에서 분리된 유산균이 대식세포를 자극해 사이토카인 TNF-α 및 IL-6의 생성을 증가시켜 세포의 면역력 강화에 중요한 역할을 한다고 보고하였는데, 본 연구에서 이를 열처리하여 조제한 LABP 또한 유사한 결과를 나타내어 포스트바이오틱스 또한 면역 기능성 소재로의 활용 가능성을 확인할 수 있었다. 따라서, 면역 증진 관련 기능성 소재로 김치 유래 유산균 포스트바이오틱스의 활용 가능성을 확인할 수 있었으며, 다음으로는 주정침전으로 분획된 고분자 및 저분자 획분의 활성 유도 획분 분리 및 활성 증진 여부를 확인하였다.
Fig. 2.
Macrophage stimulating activity of lactic acid bacteria postbiotics (LABP). RAW 264.7 cells were treated with LABP for 24 h and the production of nitric oxide (a), TNF-α (b), and IL-6 (c) was evaluated. The results are presented as the mean ± SD of three independent tests. Asterisks in the bar indicate significant differences between the negative controls (NC) and each group by the Student's t-test. *p<0.05, **p<0.01, ***p<0.001. NC; negative control, LPS; lipopolysaccharide (1 μg/mL), LABP; lactic acid bacteria postbiotics.
Download Original Figure
김치 유래 유산균 포스트바이오틱스 분획물의 대식세포 자극 활성
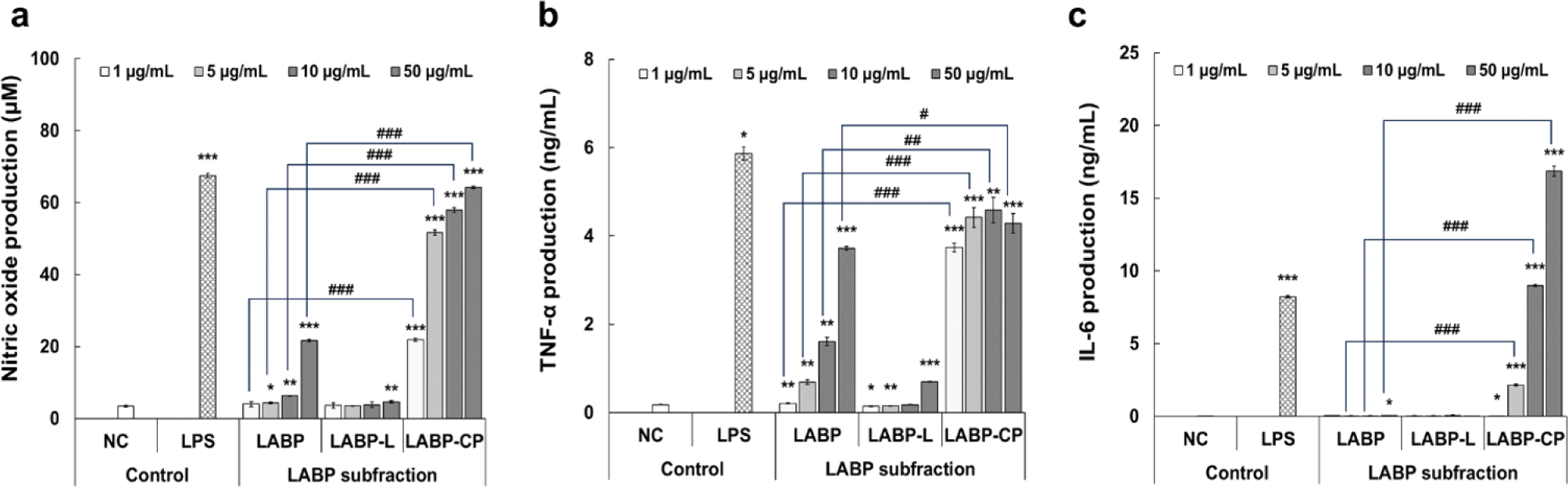
주정침전을 이용한 조다당 획분의 분획은 일반적으로 다당 또는 단백 다당 등의 고분자 물질 분리에 효과적이며, 이러한 방법으로 분획된 고분자 물질이 대식세포로부터 활성화 관련 다양한 사이토카인의 분비 촉진을 유도하여 생체 면역반응에 기여하였다고 보고하였다(Shin 등, 2021). 따라서, 본 연구에서는 LABP를 주정 침전하여 LABP 유래 저분자 획분(LABP-L) 및 고분자 조다당 획분(LABP-CP)으로 분획한 후 대식세포 자극 활성을 재평가하였다. 먼저, NO의 생성능을 확인한 결과(Fig. 3a), LABP는 NC 대조군(3.4 µM) 대비 1~50 µg/mL의 농도에서 4.1~21.7 µM(1.2~6.3배 증가)의 농도-의존적인 NO 생성능을 나타냈으나, LABP-L의 경우 50 µg/mL의 농도에서만 4.6 µM(1.3배 증가)의 NO 생성능을 보였다. 반면, LABP-CP는 1~50 µg/mL의 농도에서 21.9~64.2 µM (6.4~18.7배 증가)의 NO 생성능을 나타내어 통계적으로 가장 우수한 것으로 확인되었다. 이러한 경향은 TNF-α 및 IL-6 생성능에서 유사하게 나타났으며, LABP-CP는 각각 1~50 µg/mL의 농도 범위에서 3.7~4.6 ng/mL(21.0~25.7배 증가)의 TNF-α 생성능과 1~50 µg/mL의 농도 범위에서 0.1~16.9 ng/mL(0.7~537.1배 증가)의 통계적으로 가장 우수한 IL-6 생성능을 나타냈다. Kim 등(2022)의 연구에서 김치 유산균 발효 생약복합물 조다당 획분의 대식세포 자극 활성이 열수 추출물에 비해 우수한 활성을 나타내었는데, 본 연구에서도 이와 유사한 바, 주정침전을 통한 고분자 조다당 획분의 분획이 대식세포 활성촉진에 밀접한 관련이 있는 것으로 확인되었다.
Fig. 3.
Macrophage stimulating activity of lactic acid bacteria postbiotics (LABP) and their subfractions (LABP-L and -CP). RAW 264.7 cells were treated with LABP and their subfraction for 24 h and the production of nitric oxide (a), TNF-α (b), and IL-6 (c) was evaluated. The results are presented as the mean ± SD of three independent tests. Asterisks in the bar indicate significant differences between the negative controls (NC) and each group by the Student's t-test. Crosshatch patterns revealed significant differences between samples within the same concentration. *, # p<0.05, **, ## p<0.01, ***, ### p<0.001. NC; negative control, LPS; lipopolysaccharide (1 μg/mL), LABP; lactic acid bacteria postbiotics, LABP-L; low molecule isolated from LABP, LABP-CP; crude polysaccharide isolated from LABP.
Download Original Figure
김치 유래 유산균 포스트바이오틱스 조다당 획분의 식세포 활성
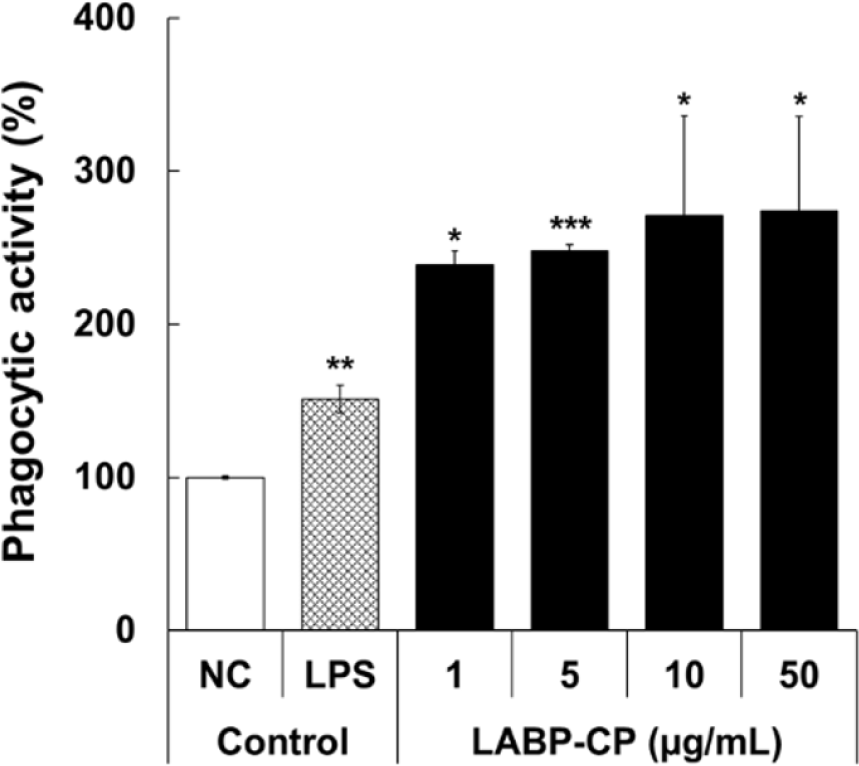
식세포 작용은 외부로부터 침입한 미생물 혹은 항원이 체내로 침입하게 되면 세포는 항상성을 유지하기 위해 원형질막을 이용하여 입자를 삼켜 내부 입자를 제거하는 과정을 의미한다. 대식세포의 식세포 작용은 특정 병원체 및 손상된 세포의 제거와 밀접한 관련을 맺고 있어(Lee 등, 2018), LABP-CP의 처리에 따른 대식세포의 식세포 활성을 분석하였다. Fig. 4에서 나타냈듯이, 양성대조군으로 이용된 LPS는 NC 대조군 대비 1 µg/mL 농도에서 151.1%의 식세포 활성을 유도한 반면, LABP-CP는 1~50 µg/mL 농도범위에서 239.9~273.7%의 우수한 식세포 활성을 나타냈다. Choi 등(1997)의 연구에서 김치 추출물과 L. plantarum 배양액이 대식세포의 탐식 기능을 상승시킨다고 보고하였는데, 본 연구의 결과를 통해 김치로부터 분리된 프로바이오틱스뿐만 아니라, 포스트바이오틱스 또한 식세포 작용을 활성화시킬 수 있음을 확인하였다. 결론적으로, 김치 유래 유산균 포스트바이오틱스 조다당 획분(LABP-CP)은 우수한 면역 자극 활성을 나타냄으로써 기능성 소재로서 산업적 활용 가능성을 제시하였으나, 향후 대식세포 활성화에 기여하는 기전에 대한 연구는 추가적으로 필요할 것으로 보인다.
Fig. 4.
Phagocytic activity of crude polysaccharide isolated from LABP (LABP-CP). RAW 264.7 cells were treated with LABP-CP for 24 h and the phagocytic activity was evaluated using a neutral red reagent. The results are presented as the mean ± SD of three independent tests. Asterisks in the bar indicate significant differences between the negative controls (NC) and each group by the Student's t-test. *p<0.05, **p<0.01, ***p<0.001. NC; negative control, LPS; lipopolysaccharide (1 μg/mL), LABP-CP; crude polysaccharide isolated from LABP.
Download Original Figure
김치 유래 유산균 포스트바이오틱스 및 분획물의 분자량 분포
HPSEC를 이용하여 LABP, LABP-L 및 LABP-CP의 분자량 분포를 분석한 결과는 Fig. 1b와 같다. LABP는 0.2 kDa의 저분자 물질과 121.2 kDa의 고분자물질이 소량 혼재되어 있는 것으로 확인되었으며 LABP-L는 0.2 kDa인 저분자 물질만이 존재하는 것으로 확인되었다. 반면, LABP-CP는 103.5~126.7 kDa의 물질이 혼재되어 있는 것을 확인할 수 있었다. 이러한 결과는 주정침전을 통해 저분자(LABP-L) 및 고분자 물질 획분(LABP-CP)이 효과적으로 분획되었음을 보여주는 것으로, 특히 조다당의 고분자 획분이 대식세포 활성화 및 식세포 작용의 활성화에 기여하고 있음을 확인할 수 있으므로, 이후 대식세포 활성화 포스트바이오틱스 분획물의 화학적 특성을 분석하고자 구성분 및 구성당 분석을 진행하였다.
김치 유래 유산균 포스트바이오틱스 및 분획물의 구성분 및 구성당 분포
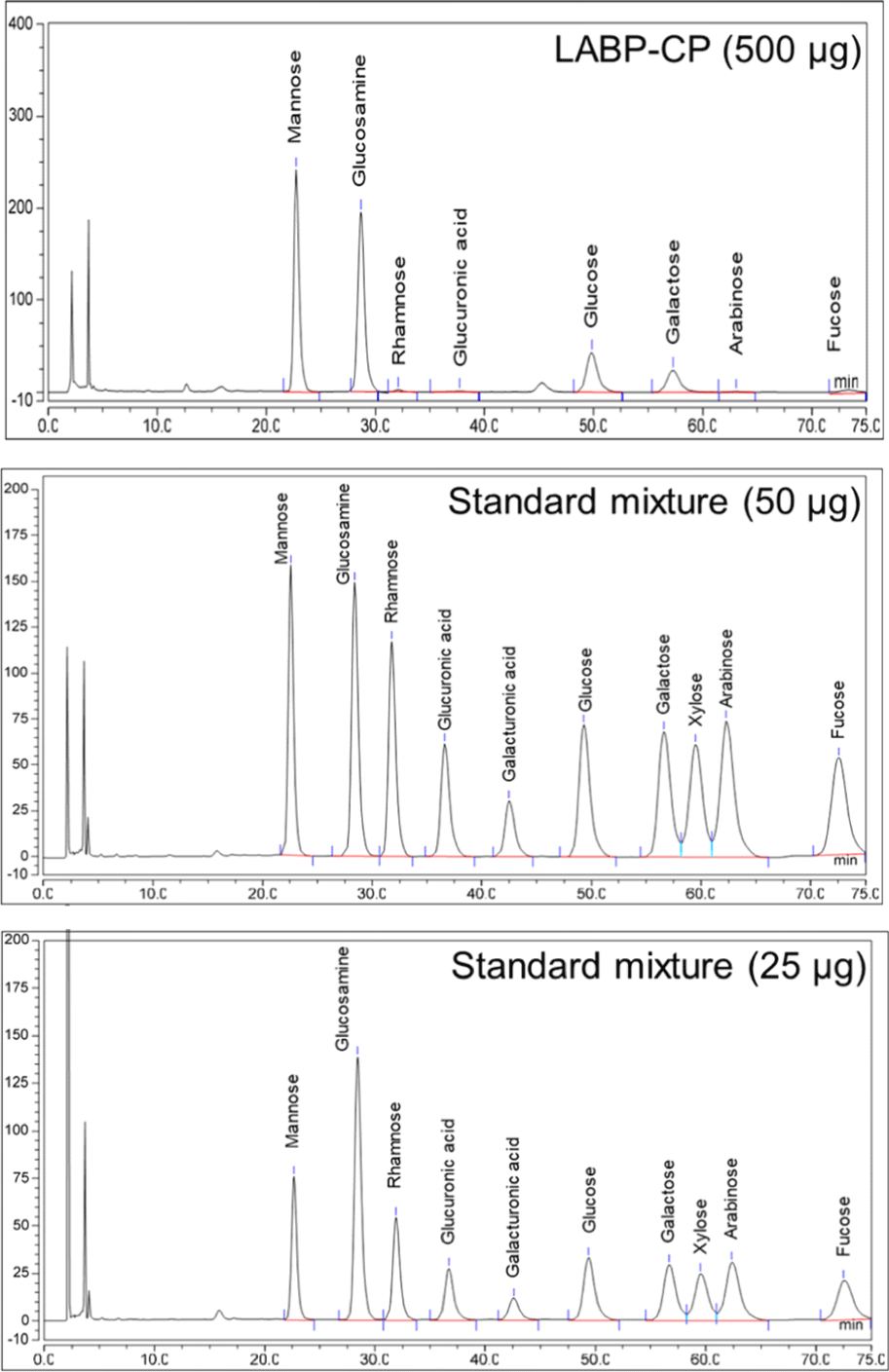
LABP, LABP-L 및 LABP-CP의 구성분 및 구성당 분석 결과는Table 2에 나타냈다. LABP 및 LABP-L은 유사한 구성분 분포를 보여, 각각 중성당(67.0 및 66.8%), 산성당(20.7 및 26.5%) 및 단백질(12.4 및 6.6%)의 함량에서 유의적인 차이를 보이지 않았다. 그러나 활성 분획물인 LABP-CP의 경우 중성당(64.7%)은 유사하였으나, 산성당은 감소(6.6%)하고 단백질은 28.7%로 중가한 분포를 확인할 수 있었다. 이와 같은 단백질 함량 증가의 가장 주요한 원인은 유산균 세포벽 내 펩티도글리칸층으로부터 유리된 아미노산 또는 단백질이 주정침전을 통해 나타나는 것으로 보이나, 이러한 성분변화가 대식세포 활성화에 기여하는지의 여부는 향후 검토가 필요한 것으로 보인다. 한편, 구성당 분포를 위한 HPLC 크로마토그램은 Fig. 5에 나타냈으며, LABP 및 LABP-L은 주로 glucose(43.4 및 45.4%) 및 galactose(37.2 및 47.3%)를 주요 구성당으로 가졌으며, LABP-CP의 경우, 주요 구성당으로 mannose(59.1%), glucose(23.0%) 및 galactose(14.0%)의 분포를 보였다(Table 2). Park 등(2022) 및 Kook 등(2019)의 연구에 따르면, 유산균(Lactobacilluss spp. 및 Leuconostoc spp.)이 생산하는 대사산물은 mannose, glucose 및 galactose로 구성되어 있다고 보고되고 있으며, 본 연구 결과를 토대로 대식세포 활성화 및 식세포 활성에 기여하는 LABP-CP는 mannan, glucomannan 및 galactomannan 등의 다당류이거나 이들과 단백질이 결합된 단백다당일 가능성을 나타내었다. 추후 ion-exchange 및 size-exclusion chromatography를 통한 분리 및 정제를 통해 LABP-CP의 대식세포 활성화에 관여하는 활성 본체를 분리하여 다당류 구성당의 결합양식 분석과 함께 단백 다당일 경우 아미노산 분석 및 단백질과 다당류 분리에 따른 활성에 미치는 영향 등을 분석하여 활성과 화학적 구조의 상관관계를 확인하고자 한다.
Table 2.
Chemical properties and monosaccharide composition of postbiotics fractions (LABP-L and -CP) by lactic acid bacteria
|
Sample |
LABP subfraction |
|
LABP |
LABP-L |
LABP-CP |
|
Chemical properties (%) |
|
|
Neutral sugar |
67.0±2.2a1)
|
66.8±1.1a
|
64.7±1.2a
|
|
Uronic acid |
20.7±0.1b
|
26.5±0.7b
|
6.6±0.0c
|
|
Protein |
12.4±1.7c
|
6.6±0.2c
|
28.7±3.6b
|
|
Sugar composition (mol %) |
|
|
Mannose |
15.9±0.3 |
3.9±0.0 |
59.1±0.2 |
|
Rhamnose |
- |
- |
0.7±0.1 |
|
Glucuronic acid |
3.4±0.2 |
3.4±0.5 |
1.2±0.0 |
|
Glucose |
43.4±0.2 |
45.4±0.2 |
23.0±0.3 |
|
Galactose |
37.2±0.3 |
47.3±0.3 |
14.0±0.0 |
|
Arabinose |
- |
- |
0.4±0.0 |
|
Fucose |
- |
- |
1.6±0.0 |
Download Excel Table
Fig. 5.
HPLC chromatogram of crude polysaccharide isolated from LABP for determining sugar composition.
Download Original Figure
요약
유산균 포스트바이오틱스로부터 면역자극 물질의 개발 가능성을 제시하기 위해 김치에서 Lactobacillus sakei 및 Leuconostoc mesenteroides를 분리하였다. 이후, 분리된 2 종의 유산균을 배양하여 대식세포 활성을 측정하기 위한 포스트바이오틱스(LABP)를 제조하였다. LABP는 NO, TNF-α 및 IL-6 등의 대식세포 자극인자의 생성을 유의하게 증가시켰다. 주정 침전법으로부터 분리한LABP-CP는 통계적으로 우수한 대식세포 자극 활성을 나타냈을 뿐만 아니라, 용량의존적으로 식세포 활성을 유도하였다. 또한LABP-CP는 103.5~126.7 kDa의 고분자 물질로 mannose (59.1%), glucose(23.0%), galactose(14.0%)를 주요 단당류 조성을 갖는 다당류로 확인되었다. 결론적으로, 김치에서 분리한 유산균으로부터 제조된 포스트바이오틱스는 면역자극 활성을 갖는 기능성 물질로서 산업적 응용이 확인되었다.
감사의글
본 논문은 2024년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력기반 지역혁신 사업의 결과입니다(2021RIS-001; 프로젝트랩).
References
Aguilar-ToaláJE, Garcia-Varela R, Garcia HS, Mata-Haro V, González-Córdova AF, Vallejo-Cordoba B, and Hernández-Mendoza A (2018) Postbiotics: An evolving term within the functional foods field.
Trends Food Sci. Technol.
75, 105-114.


Arango Duque G, and Descoteaux A (2014) Macrophage cytokines: involvement in immunity and infectious diseases.
Front Immunol.
5, 491-491.




Blumenkrantz N, and Asboe-Hansen G (1973) New method for quantitative determination of uronic acids.
Anal. Biochem.
54, 484-489.



Bradford MM (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.
Anal. Biochem.
72, 248-254.



Choi MW, Kim KH, and Young PK (1997) Effects of Kimchi extracts on the growth of Sarcoma-180 cells and phagocytic activity of mice.
J. Korean Soc. Food. Sci. Nutr.
26, 254-260.

DuBois M, Gilles KA, Hamilton JK, Rebers PA, and Smith F (1956) Colorimetric method for determination of sugars and related substances.
Anal. Chem.
28, 350-356.


Gilliland SE (1990) Health and nutritional benefits from lactic acid bacteria.
FEMS Microbiol Rev.
7, 175-188.



Honda S, Akao E, Suzuki S, Okuda M, Kakehi K, and Nakamura J (1989) High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl5-pyrazolone derivatives.
Anal. Biochem.
180, 351-357.



Hong SW (2023) Evolution of lactic acid bacteria “Postbiotics”.
Food Sci. Ind.56, 23-29.


Hur HJ, Lee KW, and Lee HJ (2004) Production of nitric oxide, tumor necrosis factor-
αand interleukin-6 by RAW 264.7 macrophage cells treated with lactic acid bacteria isolated from Kimchi.
Bio Factors.
21, 123-125.



Jang JY, and Kim TW (2013) Lactic acid bacteria in kimchi and their immunomodulatory activities.
Curr. Top. Lact. Acid Bact.1, 28-37.


Kim DY, Kim HS, Yoo JS, Cho YA, and Kim CH (2020) Antioxidant activity of lactic acid bacteria isolated from Korean traditional food Kimchi.
J. Dairy Sci. Biotechnol.
38, 89-98.


Kim G, Shin HY, Jeong SB, Ha EJ, Jeong EJ, Shin JY, and Yu KW (2022) Enhanced macrophage stimulatory activities of extracts from Kimchi lactic acid bacteria- fermented mixed herbal medicines.
Korean J. Food Nutr.
35, 399-410.

Kim HR, Kim DY, Choi JH, and Ou LB (2023a) Curation service strategy for health functional food : focusing on case studies of customized health functional food in Korea.
KLRI.
16, 63-78.


Kim SH, Cho DH, Ryu YG, Lee SJ, Bae YR, and Chung MJ (2023b) Immunostimulatory effect of lactic acid bacteria fermentation using mixtures of barley sprout, plant mixed extract, and baechu.
J. Korean Soc. Food Sci. Nutr.
52, 1091-1100.


Kim YA, Jeong SJ, Choi JH, Bae JM, Um MY, and Kim EJ (2023c) Current status of research on functional ingredients and proposals for enhancing reliability of authorization and research efficiency.
Food Sci. Ind.56, 213-219.


Kim YS, Shin HY, Jeong WB, Ha EJ, Koo JP, Shin JY, and Yu KW (2024) Effect of
Astragalus membranaceus- postbiotics polysaccharide changed by lactic acid bacteria on macrophag.
J. Korean Soc. Food Sci. Nutr.37, 17-29.

Kook SY, Lee YL, Jeong EC, and Kim SJ (2019) Immunomodulatory effects of exopolysaccharides produced by
Bacillus licheniformis and
Leuconostoc mesenteroides isolated from Korean Kimchi.
J. Funct. Foods.
54, 211-219.


Lee JH, Ahn DU, and Paik HD (2018)
In vitro immune-enhancing activity of ovotransferrin from egg white
viaMAPK signaling pathways in RAW 264.7 macrophages.
Food Sci. Anim. Resour.
38, 1226-1236.




Lee SY, Jeong HS, Lee MY, Kim KH, Choi JH, Kwon KI, and Lee HY (2024) Development of a method for the simultaneous analysis of gallic scid and caffeine in health functional foods containing Pu-erh tea extract.
J. Korean Soc. Food Sci. Nutr.
53, 53-62.


Liang B, and Xing D (2023) The current and future perspectives of postbiotics.
Probiotics Antimicrob Proteins.
15, 1626-1643.




Lim JH, Yoon SM, Tan PL, Yang S, Kim SH, and Park HJ (2018) Probiotic properties of
Lactobacillus plantarum LRCC5193, a plant-origin lactic acid bacterium isolated from Kimchi and its use in chocolates.
J. Food Sci.83, 2802-2811.



Martinez FO, Sica A, Mantovani A, and Locati M (2008) Macrophage activation and polarization.
Front Biosci.
13, 453-461.



Park KY (2012) Increased health functionality of fermented food.
Food Industry and Nutrition.
17, 9-16.

Park KY, and Hong GH (2019) Kimchi and its functionality.
J. Korean Soc. Food Cult.34, 142-158.

Park KY, Jeong JK, Lee Ey, and DailyIII JW (2014) Health benefits of Kimchi (Korean fermented vegetables) as a probiotic food.
J. Med. Food.
17, 6-20.



Park S, Saravanakumar K, Sathiyaseelan A, Park S, Hu X, and Wang M-H (2022) Cellular antioxidant properties of nontoxic exopolysaccharide extracted from Lactobacillales (
Weissella cibaria) isolated from Korean Kimchi.
LWT.
154, 112727.


Park YJ (2017) Isolation and characterization of Kimchi lactic acid showing antibacterial activity.
Korean Journal of Human Ecology.
26, 547-558.


Salminen S, Collado MC, Endo A, Hill C, Lebeer S, Quigley EMM, Sanders ME, Shamir R, Swann JR, Szajewska H, and Vinderola G (2021) The international scientific association of probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics.
Nat. Rev. Gastroenterol Hepatol.
18, 649-667.




Seo YE, Yoon YH, and Kim SJ (2019) Functionality and safety of probiotics.
J. Dairy Sci. Biotechnol.
37, 94-101.


Shin HY, Kim H, Shin JY, Lee SJ, and Yu KW (2021) The physiological activity of crude polysaccharide solvent extracted from herbal medicine mixture.
Korean J. Food Nutr.
34, 36-46.

Song SY, Jeong JW, Kim KH, Park DJ, and Oh SJ (2015) Antimutagenicity of the cell extracts of lactic acid bacteria against 4-nitroquinoline 1-oxide.
Curr. Top. Lact. Acid Bact.3, 28-33.


Sung JY, Jung HR, Park JI, Jin JH, and Yoon DH (2022) Postbiotic properties of lactic acid bacteria isolated from Korean traditional Nuruk.
J. Korea Content. Assoc.22, 778-785.


Tursun X, Zhao Y, Alat Z, Xin X, Tursun A, Abdulla R, and AkberAisa H (2016) Anti-inflammatory effect of
Rosa rugosa flower extract in lipopolysaccharide- stimulated RAW264.7 macrophages.
Biomol. Ther.
24, 184-190.




Williams NT (2010) Probiotics.
Am. J. Health Syst. Pharm.
67, 449-458.



You BR, Kim Eg, Jang JY, Choi HJ, and Kim HJ (2013) Quality characteristics of Kimchi with
Allium hookeriroot powder added.
Korean J. Food Preserv.20, 863-870.


Żółkiewicz J, Marzec A, Ruszczyński M, and Feleszko W (2020) Postbioticsa step beyond pre and probiotics.
Nutrients.
12, 2189.